Оператор генетика: Оператор (генетика): определение и функция
Содержание
Урок 8. работы генов прокариот и эукариот. вирусы. генная и клеточная инженерия — Биология — 10 класс
Работы генов прокариот и эукариот. Генная и клеточная инженерия
Вирусы
Необходимо запомнить
ВАЖНО!
Ген – это фрагмент молекулы ДНК, содержащий регуляторные элементы и структурную область, и соответствующий одной единице транскрипции, которая определяет возможность синтеза полипептидной цепи или молекулы РНК.
Ген прокариот называется опероном, в его состав входят два основных участка:
- регуляторный (неинформативный),
- структурный (информативный).
У прокариот на долю регуляторных элементов приходится около 10 %, структурных – 90 %.
Структурная область гена прокариот (единицы транскрипции) может быть представлена одним кодирующим участком, который называется цистроном, либо несколькими кодирующими участками (полицистронная единица транскрипции).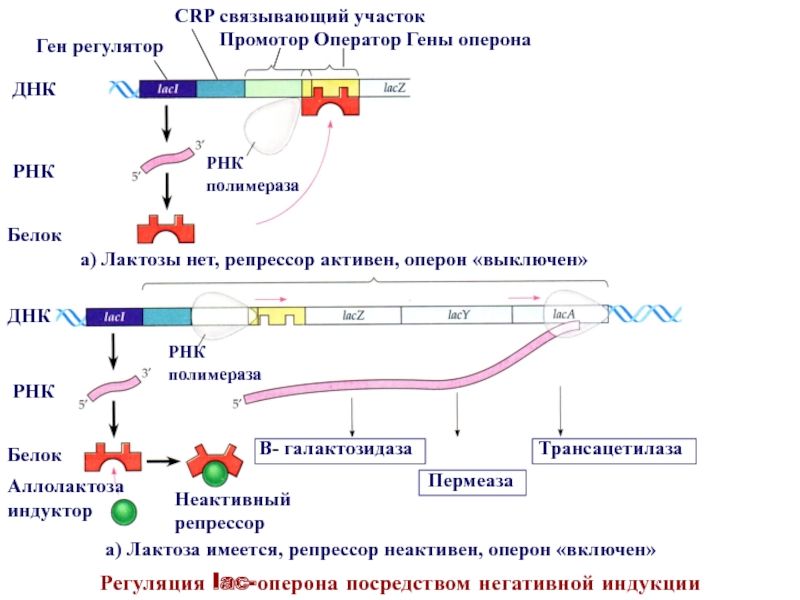 В структурной зоне при помощи генетического кода закодирована информация о последовательности аминокислот белка. Со структурной области считывается иРНК. При наличии у прокариот полицистронной единицы транскрипции на одном структурном участке одновременно может синтезироваться несколько разновидностей иРНК. К регуляторным элементам генов прокариот относятся участки, управляющие работой гена:
В структурной зоне при помощи генетического кода закодирована информация о последовательности аминокислот белка. Со структурной области считывается иРНК. При наличии у прокариот полицистронной единицы транскрипции на одном структурном участке одновременно может синтезироваться несколько разновидностей иРНК. К регуляторным элементам генов прокариот относятся участки, управляющие работой гена:
- промотор,
- оператор,
- терминатор.
Промотор определяет начало транскрипции (участок инициации). С промотором соединяется фермент РНК-полимераза, осуществляющий синтез мРНК. Другой элемент, управляющий процессом транскрипции, – оператор, который располагается поблизости от промотора или внутри него. Этот участок может быть свободным, тогда РНК-полимераза соединяется с промотором и начинается транскрипция. Если оператор связан с белком-репрессором, РНК-полимераза не может нормально соединиться с промотором, и транскрипция невозможна. Следующий регуляторный элемент – терминатор – находится за структурной областью и содержит сигнальный участок остановки транскрипции._und_entwicklung/08.14variabilitaet_des_erbguts/Lac-Operon-inaktiv.png)
Механизм функционирования системы регуляции синтеза белка был открыт в 1962 году Жакобом и Моно при исследовании культивирования кишечной палочки в лактозной среде и назван lac-опероном.
Упрощённо этот механизм может быть описан следующим образом. На основе информации гена-регулятора синтезируется белок-репрессор; если он активный, он связывается с геном-оператором, перекрывая путь для РНК-полимеразы – процесс трансляции и последующего синтеза белка выключается (запрещается). Если появляется индуктор (например, лактоза в lac-опероне), он присоединяется к белку-репрессору, приводя его в неактивное состояние. Оператор становится активным и включает процесс считывания информации со структурных генов – разрешает трансляцию. Происходит считывание информации с ДНК, начинается синтез необходимого белка – фермента (например, фермента, расщепляющего лактозу в lac-опероне).
Это только один из возможных механизмов регуляции активности генов у прокариот, который называется запрещающей индукцией.
Строение генов у эукариот намного сложнее. Генетическая система эукариот называется транскриптоном. Транскриптон также состоит из двух частей:
- регуляторной (неинформативной),
- структурной (информативной),
относительная пропорция которых противоположна генам прокариот: на долю регуляторного участка приходится 90 %, структурного – 10 %.
Регуляторный участок представляет собой ряд последовательно расположенных промоторов и операторов и несколько терминаторов. Структурный участок состоит из одной единицы транскрипции и имеет “прерывистое” строение: кодирующие участки (экзоны) чередуются с некодирующими (интронами). Одномоментно на структурном участке у эукариот может синтезироваться только одна молекула иРНК, однако благодаря наличию альтернативного сплайсинга в разное время (в зависимости от потребности клетки) на одной и той же структурной части могут синтезироваться разные виды иРНК (от одной до нескольких десятков).
Строение вируса
Интерактивная схема «Генная инженерия»
Генетический алгоритм: операторы | LAZY SMART
В одной из предыдущих статей мы рассмотрели общую схему генетического алгоритма (ГА), узнали, как он работает и где применяется. Эта статья посвящена реализации ГА, поэтому если вы еще не знакомы с самим понятием «генетический алгоритм», рекомендую прочитать вводную статью. Прочитали? Тогда едем дальше…
Эта статья посвящена реализации ГА, поэтому если вы еще не знакомы с самим понятием «генетический алгоритм», рекомендую прочитать вводную статью. Прочитали? Тогда едем дальше…
По аналогии с живой природой в ГА используются такие понятия как наследственность, изменчивость и искусственный отбор. Последние два реализуются с помощью генетических операторов. Понятие «наследственность» заложено в самом алгоритме: базой для создания новой популяции являются особи предыдущей популяции.
Операторы, реализующие понятие «изменчивость» делятся на две большие группы: операторы скрещивания и мутации.
Оператор скрещивания
В операторах скрещивания выполняется генерация 1 – 2 потомков для уменьшения временной сложности работы алгоритма.
Оператор скрещивания реализуется в два этапа:
- Подбор особей в родительскую пару
- Скрещивание родительской пары с помощью одной из схем скрещивания
Схемы подбора особей родительскую пару
- Панмиксия(случайный способ) – система, в которой любые две особи имеют одинаковую вероятность создать родительскую пару.
 Данная система является универсальной для решения различных классов задач, однако, она достаточно критична к численности популяции, т.е. эффективность алгоритма, использующего такой подход, снижается с увеличением числа особей.
Данная система является универсальной для решения различных классов задач, однако, она достаточно критична к численности популяции, т.е. эффективность алгоритма, использующего такой подход, снижается с увеличением числа особей. - Инбридинг/Аутбридинг — схема, в которой учитывается степень родства (ближнее/дальнее).
Хеммингово расстояние – критерий определения степени родства – число различных генов в строках-хромосомах, описывающих две особи.
Две особи являются «близкими родственниками», если хеммингово расстояние между их генотипами не превышает некоторого заданного положительного целого числа d0 (d≤d0), т.е. генотипы отличаются между собой не более чем на d0 в битах.
Пара особей, для которых данное условие не выполняется, называются «неродственными».
Система скрещивания, в которой предпочтение отдаётся генетически похожим особям, называется инбридингом, а генетически непохожим – аутбридингом.
Эффективным является использование на начальных этапах работы алгоритма инбридинга, а на заключительных этапах – аутбридинга.
- Ассоциативное скрещивание – основано на оценке функции пригодности.
Фенотип – полное представление особи в популяции. Фенотип фактически определяется функцией пригодности.
Особи могут подбираться в родительскую пару по близкому фенотипу (положительное ассоциативное скрещивание), а в случае подбора по сильно отличающемуся фенотипу говорят об отрицательном ассоциативном скрещивании.
Схемы реализации оператора скрещивания
- Рекомбинация
Ведёт к появлению новых сочетаний родительских генов. Хромосомы родителей сравниваются по содержанию каждого гена. Если в i-том локусе гены родителей совпадают — потомки получают такой же ген в этом локусе. В противном случае в i-тый локус потомка заносится ген одного из родителей с вероятностью 50%.
- Кроссинговер
При кроссинговере хромосомы родителей разрываются в одном и том же месте, а затем обмениваются последовательными участками хромосом.
Точка разрыва (точка кроссинговера) может находиться в любой позиции хромосомы в общем случае с равной вероятностью.
Оператор мутации
- Точечная мутация
Осуществляется в пределах одного гена, при этом потомок в общем случае содержит генотип родителя со слегка искажённой информацией. Используют для битового кодирования.
- Генная мутация
Оператор реализует боле глубокие изменения на уровне гена. Используется для битового кодирования.
На схеме особи представлены в виде строк-хромосом, состоящих из трёх генов. Каждый из генов — значение параметра задачи. Например, если ищем оптимум в функции f(x1,x2,x3), тогда значение x1 – ген 1, x2 – ген 2, x3 – ген 3, а набор х1, х2, х3 – хромосома (решение задачи). В пределах гена мутация каждой аллели происходит случайным образом.
В пределах гена мутация каждой аллели происходит случайным образом.
- Макромутация
Макромутация является обобщением точечных и генных мутаций и сводится к многократному использованию одной из схем мутации для отдельной строки-хромосомы.
- Инверсия
Потомок формируется за счёт реализации противоположной последовательности аллель-формы родителя. Используется для целочисленного кодирования.
- Перестановка
Используется для целочисленного кодирования.
Оператор отбора
Отбор осуществляется по функции пригодности (ФП).
Отбор – процесс формирования новой популяции, который способствует сохранению более приспособленных особей (имеющих большую ФП) и элиминации менее приспособленных.
Оператор отбора реализуется в два этапа:
- Формирование репродукционной группы
- Отбор наиболее приспособленных особей из репродукционной группы в следующую популяцию
Репродукционная группа – совокупность особей (родителей, потомков) поколения t, из которых ведётся отбор k особей (численность популяции), включаемых в состав популяции на поколении t+1.
Схемы формирования репродукционной группы
- Общая схема
В репродукционную группу входят все особи поколения t: родители и потомки, полученные в результате выполнения операторов скрещивания и мутации.
- Элитарная схема
В репродукционную группу включаются все родители и только те потомки, ФП которых больше чем хотя бы у одного из родителей.
- Селекционные схемы
Схема 1. В репродукционную группу включают все особи, ФП которых больше средней ФП родителей и потомков.
Схема 2. Разработчик задаёт численность К2 репродукционной группы, и в неё входят все К2 лучших особей из числа родителей и потомков.
Схемы отбора
- Схема жёсткого отбора
Реализуется с помощью задания распределения вероятностей для каждой особи.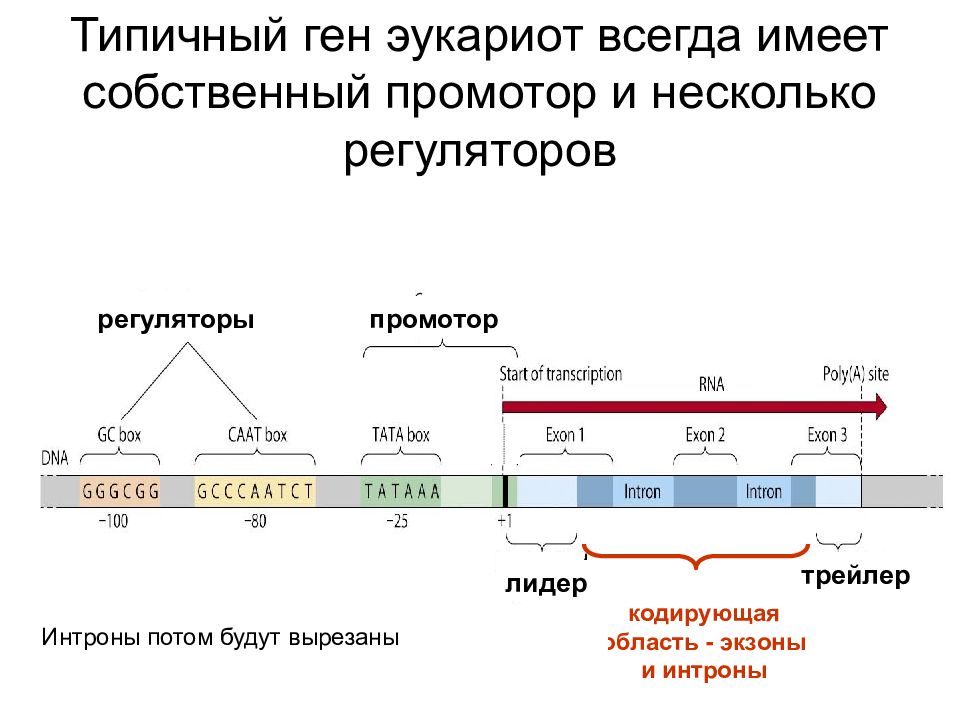
После определения вероятностей применяется схема отбора «колесо рулетки».
Рулетка «крутится» К раз на случайный угол, выбирая одну из особей в следующее поколение. Чем больше ФП особи, тем больше вероятность, что она попадёт в следующее поколение.
- Схема мягкого отбора
Основана на информации о рангах особей, расположенных по убыванию ФП.
Схема отдаёт предпочтение особям с высокими рангами и приводит к более медленному, чем в схеме жёсткого отбора, уменьшению генетического разнообразия популяции.
- Схема отбора с вытеснением
В этой схеме отбора из репродукционной группы в новую популяцию отбираются особи не только согласно величине ФП, но также учитывая условие: имеется ли уже в популяции особь с похожим генотипом.
Ученые объяснили, какие мутации могут помешать браку
https://ria. ru/20200219/1564930704.html
ru/20200219/1564930704.html
Ученые объяснили, какие мутации могут помешать браку
Ученые объяснили, какие мутации могут помешать браку — РИА Новости, 19.02.2020
Ученые объяснили, какие мутации могут помешать браку
Ученый из Гарварда Джордж Черч разрабатывает приложение для ДНК-знакомств. Пользователи смогут выбирать из нескольких подходящих кандидатов тех, с кем нет общих РИА Новости, 19.02.2020
2020-02-19T08:00
2020-02-19T08:00
2020-02-19T11:25
наука
центральный нии эпидемиологии роспотребнадзора
генетика
геном
днк
гормоны
здоровье
открытия — риа наука
гарвардский университет
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/07e4/02/13/1564957963_70:83:919:561_1920x0_80_0_0_d12efc8fcee02a9f4e6e1d16e4773aca.jpg
МОСКВА, 19 фев — РИА Новости, Альфия Еникеева. Ученый из Гарварда Джордж Черч разрабатывает приложение для ДНК-знакомств. Пользователи смогут выбирать из нескольких подходящих кандидатов тех, с кем нет общих рецессивных мутаций. У таких пар ничтожно мал риск рождения детей с наследственными заболеваниями. Коллеги обвиняют исследователя в заигрывании с евгеникой. Он ссылается на то, что предлагает тестировать только на гены, важные с медицинской точки зрения, — так уже поступают во многих странах мира. РИА Новости разбирается, насколько реально подобрать генетически идеального партнера и как это сделать. Удачный экспериментВ 1969 году ученые доказали, что болезнь Тея — Сакса, когда дети после полугода начинают деградировать в развитии и умирают, — наследственная. Недуг поражает ребенка в случае, если он получает по одной мутантной версии гена HEXA от каждого родителя.Наиболее распространена мутация среди евреев-ашкеназов. Каждый тридцатый представитель этой общности имеет в своей ДНК поврежденный вариант HEXA.В 1983 году врачи стали тестировать всех здоровых подростков, принадлежащих к этой общности и проживающих в Нью-Йорке, на наличие мутации.
Пользователи смогут выбирать из нескольких подходящих кандидатов тех, с кем нет общих рецессивных мутаций. У таких пар ничтожно мал риск рождения детей с наследственными заболеваниями. Коллеги обвиняют исследователя в заигрывании с евгеникой. Он ссылается на то, что предлагает тестировать только на гены, важные с медицинской точки зрения, — так уже поступают во многих странах мира. РИА Новости разбирается, насколько реально подобрать генетически идеального партнера и как это сделать. Удачный экспериментВ 1969 году ученые доказали, что болезнь Тея — Сакса, когда дети после полугода начинают деградировать в развитии и умирают, — наследственная. Недуг поражает ребенка в случае, если он получает по одной мутантной версии гена HEXA от каждого родителя.Наиболее распространена мутация среди евреев-ашкеназов. Каждый тридцатый представитель этой общности имеет в своей ДНК поврежденный вариант HEXA.В 1983 году врачи стали тестировать всех здоровых подростков, принадлежащих к этой общности и проживающих в Нью-Йорке, на наличие мутации. Ни школьники, ни их родители результатов анализов не получали, но в их распоряжении оказывался уникальный идентификационный код. Много лет спустя, решив создать семьи, парень с девушкой могли позвонить по специальному номеру и назвать свои последовательности цифр. Оператор в ответ сообщал, какова вероятность того, что у пары родится ребенок с болезнью Тея — Сакса. А дальше выбор был уже за молодыми. Так что сегодня количество случаев болезни Тея — Сакса среди нью-йоркских ашкеназов уменьшилось.ДНК-знакомстваПохожий подход предлагает использовать генетик из Гарвардского университета (США) Джордж Черч. В интервью американскому телеканалу CBSN ученый рассказал, что работает над приложением для знакомств, позволяющим уменьшить риск появления детей с наследственными заболеваниями.По его словам, каждый пользователь при регистрации будет проходить полногеномное секвенирование. Это позволит выявить все возможные скрытые мутации в его ДНК. Но доступа к результатам анализа он не получит. Данные будут храниться в приложении в закодированном виде и использоваться только для исключения неподходящих кандидатов.
Ни школьники, ни их родители результатов анализов не получали, но в их распоряжении оказывался уникальный идентификационный код. Много лет спустя, решив создать семьи, парень с девушкой могли позвонить по специальному номеру и назвать свои последовательности цифр. Оператор в ответ сообщал, какова вероятность того, что у пары родится ребенок с болезнью Тея — Сакса. А дальше выбор был уже за молодыми. Так что сегодня количество случаев болезни Тея — Сакса среди нью-йоркских ашкеназов уменьшилось.ДНК-знакомстваПохожий подход предлагает использовать генетик из Гарвардского университета (США) Джордж Черч. В интервью американскому телеканалу CBSN ученый рассказал, что работает над приложением для знакомств, позволяющим уменьшить риск появления детей с наследственными заболеваниями.По его словам, каждый пользователь при регистрации будет проходить полногеномное секвенирование. Это позволит выявить все возможные скрытые мутации в его ДНК. Но доступа к результатам анализа он не получит. Данные будут храниться в приложении в закодированном виде и использоваться только для исключения неподходящих кандидатов.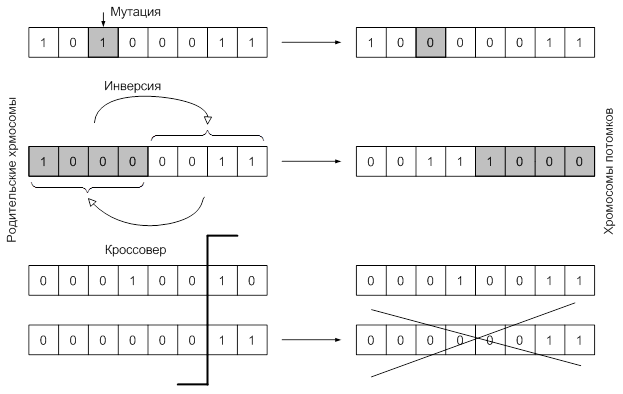 Таким образом, носитель дефектного гена не увидит анкету человека с такой же мутацией.На своей страничке на официальном сайте Гарвардского университета Черч уточнил, что не будет сортировать пользователей по уровню интеллекта или происхождению — исключительно по мутациям, важным с медицинской точки зрения. А значит, увидеть друг друга не смогут только пять процентов потенциальных пользователей. Остальные окажутся совместимы друг с другом.Семейные мутации»ДНК-тестирование на совместимость пары имеет смысл при наличии наследственных болезней в семье одного из партнеров. В геноме каждого человека есть пять-семь скрытых мутаций, ответственных за развитие аутосомно-рецессивных заболеваний. То есть чтобы проявилась клиническая картина болезни, необходима встреча двух людей с одинаковыми повреждениями в одном и том же гене. Вероятность рождения ребенка с наследственной патологией у такой пары составляет 25 процентов, что считается высоким генетическим риском. При известном семейном характере наследственного заболевания пара имеет все шансы на рождение здорового потомства, тем более что современные репродуктивные технологии позволяют обходить многие генетические особенности», — пояснила РИА Новости эксперт Центра молекулярной диагностики ЦНИИ эпидемиологии Роспотребнадзора, врач лабораторной генетики Екатерина Антипова.
Таким образом, носитель дефектного гена не увидит анкету человека с такой же мутацией.На своей страничке на официальном сайте Гарвардского университета Черч уточнил, что не будет сортировать пользователей по уровню интеллекта или происхождению — исключительно по мутациям, важным с медицинской точки зрения. А значит, увидеть друг друга не смогут только пять процентов потенциальных пользователей. Остальные окажутся совместимы друг с другом.Семейные мутации»ДНК-тестирование на совместимость пары имеет смысл при наличии наследственных болезней в семье одного из партнеров. В геноме каждого человека есть пять-семь скрытых мутаций, ответственных за развитие аутосомно-рецессивных заболеваний. То есть чтобы проявилась клиническая картина болезни, необходима встреча двух людей с одинаковыми повреждениями в одном и том же гене. Вероятность рождения ребенка с наследственной патологией у такой пары составляет 25 процентов, что считается высоким генетическим риском. При известном семейном характере наследственного заболевания пара имеет все шансы на рождение здорового потомства, тем более что современные репродуктивные технологии позволяют обходить многие генетические особенности», — пояснила РИА Новости эксперт Центра молекулярной диагностики ЦНИИ эпидемиологии Роспотребнадзора, врач лабораторной генетики Екатерина Антипова. Кроме того, сегодня также известны гены, вариации в которых могут играть роль в развитии некоторых особенностей поведения. Это, в свою очередь, скажется и на отношениях внутри семьи.»Вариации в гене транспортера серотонина способны влиять на ощущение удовлетворенности жизнью. Носители коротких аллелей этого гена больше склонны к тревожности, стрессам и депрессиям. Людям, ДНК которых содержит его длинные версии, чаще свойственны оптимизм и положительная обработка информации. Также на модель человеческого поведения способны влиять полиморфизмы — вариации — в генах дофаминового рецептора и рецептора окситоцина. Первые связаны с проявлением более агрессивного, импульсивного поведения. Вторые — с повышенной эмпатией и стрессоустойчивостью. Таким образом, принимая во внимание генетические аспекты, мы можем прогнозировать особенности поведения в семейной жизни. Но не надо забывать, что полиморфизм определяет только предрасположенность. А ее развитие зависит от условий внешней среды и образа жизни», — подчеркнула Екатерина Антипова.
Кроме того, сегодня также известны гены, вариации в которых могут играть роль в развитии некоторых особенностей поведения. Это, в свою очередь, скажется и на отношениях внутри семьи.»Вариации в гене транспортера серотонина способны влиять на ощущение удовлетворенности жизнью. Носители коротких аллелей этого гена больше склонны к тревожности, стрессам и депрессиям. Людям, ДНК которых содержит его длинные версии, чаще свойственны оптимизм и положительная обработка информации. Также на модель человеческого поведения способны влиять полиморфизмы — вариации — в генах дофаминового рецептора и рецептора окситоцина. Первые связаны с проявлением более агрессивного, импульсивного поведения. Вторые — с повышенной эмпатией и стрессоустойчивостью. Таким образом, принимая во внимание генетические аспекты, мы можем прогнозировать особенности поведения в семейной жизни. Но не надо забывать, что полиморфизм определяет только предрасположенность. А ее развитие зависит от условий внешней среды и образа жизни», — подчеркнула Екатерина Антипова. Провериться на совместимостьПо мнению американских и британских исследователей, залог прочного брака — правильная версия гена OXTR, связанного с синтезом окситоцина — гормона, регулирующего чувство тревоги. Проверив ДНК 178 супружеских пар, ученые выяснили: если один из супругов — носитель GG-генотипа (определенного варианта OXTR), оба партнера будут удовлетворены семейной жизнью. Люди, в чьей ДНК есть эта версия гена, редко испытывают тревожную привязанность к партнеру. А значит, они меньше страдают от низкой самооценки и не нуждаются в постоянном одобрении всех своих действий.Впрочем, авторы работы не советуют при выборе мужа или жены ориентироваться на результаты их исследования. Во-первых, одни и те же гены способны одновременно влиять на огромное количество признаков, и трудно предсказать, как еще GG-генотип проявится в поведении человека. Во-вторых, ни один признак не определяется мутацией в единственном гене. Исключение — наследственные болезни, для развития которых достаточно получить по одной версии поврежденного гена от каждого родителя.
Провериться на совместимостьПо мнению американских и британских исследователей, залог прочного брака — правильная версия гена OXTR, связанного с синтезом окситоцина — гормона, регулирующего чувство тревоги. Проверив ДНК 178 супружеских пар, ученые выяснили: если один из супругов — носитель GG-генотипа (определенного варианта OXTR), оба партнера будут удовлетворены семейной жизнью. Люди, в чьей ДНК есть эта версия гена, редко испытывают тревожную привязанность к партнеру. А значит, они меньше страдают от низкой самооценки и не нуждаются в постоянном одобрении всех своих действий.Впрочем, авторы работы не советуют при выборе мужа или жены ориентироваться на результаты их исследования. Во-первых, одни и те же гены способны одновременно влиять на огромное количество признаков, и трудно предсказать, как еще GG-генотип проявится в поведении человека. Во-вторых, ни один признак не определяется мутацией в единственном гене. Исключение — наследственные болезни, для развития которых достаточно получить по одной версии поврежденного гена от каждого родителя.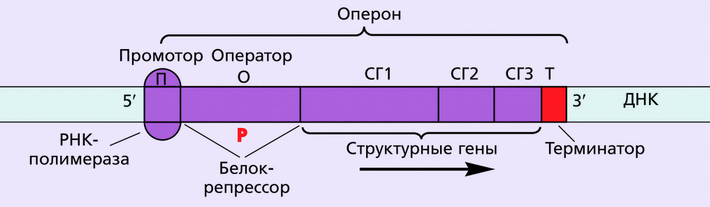 «Если в будущем перед походом в загс молодые люди станут посещать врача-генетика, то, скорее всего, речь пойдет о выявлении мутаций, вызывающих самые частые аутосомно-рецессивные заболевания. Кроме того, можно будет провести анализ кариотипа и совместимости по HLA-антигенам II класса. Все мы отличаемся по этим антигенам. Ребенок получает половину от мамы, половину от папы. В начале беременности чужеродные для организма матери отцовские антигены плода вызывают выработку специальных антител. Они, в свою очередь, защищают эмбрион от клеток материнской иммунной системы (натуральных киллеров). В результате беременность протекает нормально. Если же у родителей совпадают четыре и более антигена HLA II класса, вырабатывается меньше защитных антител или же этого не происходит вовсе. В этом случае иммунная система матери расценивает развивающийся плод как скопление опухолевых клеток и старается его уничтожить. Поэтому, зная об индивидуальных генетических особенностях заранее, люди будут готовы к некоторым возможным трудностям.
«Если в будущем перед походом в загс молодые люди станут посещать врача-генетика, то, скорее всего, речь пойдет о выявлении мутаций, вызывающих самые частые аутосомно-рецессивные заболевания. Кроме того, можно будет провести анализ кариотипа и совместимости по HLA-антигенам II класса. Все мы отличаемся по этим антигенам. Ребенок получает половину от мамы, половину от папы. В начале беременности чужеродные для организма матери отцовские антигены плода вызывают выработку специальных антител. Они, в свою очередь, защищают эмбрион от клеток материнской иммунной системы (натуральных киллеров). В результате беременность протекает нормально. Если же у родителей совпадают четыре и более антигена HLA II класса, вырабатывается меньше защитных антител или же этого не происходит вовсе. В этом случае иммунная система матери расценивает развивающийся плод как скопление опухолевых клеток и старается его уничтожить. Поэтому, зная об индивидуальных генетических особенностях заранее, люди будут готовы к некоторым возможным трудностям.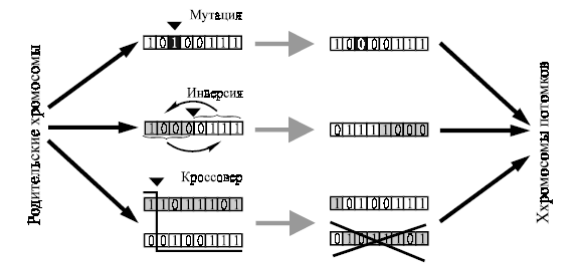 А их благодаря развитию современных репродуктивных технологий вполне можно обойти», — пояснила Екатерина Антипова.
А их благодаря развитию современных репродуктивных технологий вполне можно обойти», — пояснила Екатерина Антипова.
https://sn.ria.ru/20171220/1511282408.html
https://ria.ru/20171208/1510486710.html
https://ria.ru/20190402/1552300297.html
нью-йорк (город)
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/07e4/02/13/1564957963_135:0:903:576_1920x0_80_0_0_c98cf64587aab8b4b1e3d513727d9a00. jpg
jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
центральный нии эпидемиологии роспотребнадзора, генетика, геном, днк, гормоны, здоровье, открытия — риа наука, гарвардский университет, нью-йорк (город)
МОСКВА, 19 фев — РИА Новости, Альфия Еникеева. Ученый из Гарварда Джордж Черч разрабатывает приложение для ДНК-знакомств. Пользователи смогут выбирать из нескольких подходящих кандидатов тех, с кем нет общих рецессивных мутаций. У таких пар ничтожно мал риск рождения детей с наследственными заболеваниями. Коллеги обвиняют исследователя в заигрывании с евгеникой. Он ссылается на то, что предлагает тестировать только на гены, важные с медицинской точки зрения, — так уже поступают во многих странах мира. РИА Новости разбирается, насколько реально подобрать генетически идеального партнера и как это сделать.
РИА Новости разбирается, насколько реально подобрать генетически идеального партнера и как это сделать.
Удачный эксперимент
В 1969 году ученые доказали, что болезнь Тея — Сакса, когда дети после полугода начинают деградировать в развитии и умирают, — наследственная. Недуг поражает ребенка в случае, если он получает по одной мутантной версии гена HEXA от каждого родителя.
Наиболее распространена мутация среди евреев-ашкеназов. Каждый тридцатый представитель этой общности имеет в своей ДНК поврежденный вариант HEXA.В 1983 году врачи стали тестировать всех здоровых подростков, принадлежащих к этой общности и проживающих в Нью-Йорке, на наличие мутации. Ни школьники, ни их родители результатов анализов не получали, но в их распоряжении оказывался уникальный идентификационный код. Много лет спустя, решив создать семьи, парень с девушкой могли позвонить по специальному номеру и назвать свои последовательности цифр. Оператор в ответ сообщал, какова вероятность того, что у пары родится ребенок с болезнью Тея — Сакса. А дальше выбор был уже за молодыми. Так что сегодня количество случаев болезни Тея — Сакса среди нью-йоркских ашкеназов уменьшилось.
А дальше выбор был уже за молодыми. Так что сегодня количество случаев болезни Тея — Сакса среди нью-йоркских ашкеназов уменьшилось.
ДНК-знакомства
Похожий подход предлагает использовать генетик из Гарвардского университета (США) Джордж Черч. В интервью американскому телеканалу CBSN ученый рассказал, что работает над приложением для знакомств, позволяющим уменьшить риск появления детей с наследственными заболеваниями.
20 декабря 2017, 08:00
Зов предков: откуда у новорожденных в регионах России генетические болезни
По его словам, каждый пользователь при регистрации будет проходить полногеномное секвенирование. Это позволит выявить все возможные скрытые мутации в его ДНК. Но доступа к результатам анализа он не получит. Данные будут храниться в приложении в закодированном виде и использоваться только для исключения неподходящих кандидатов. Таким образом, носитель дефектного гена не увидит анкету человека с такой же мутацией.
На своей страничке на официальном сайте Гарвардского университета Черч уточнил, что не будет сортировать пользователей по уровню интеллекта или происхождению — исключительно по мутациям, важным с медицинской точки зрения.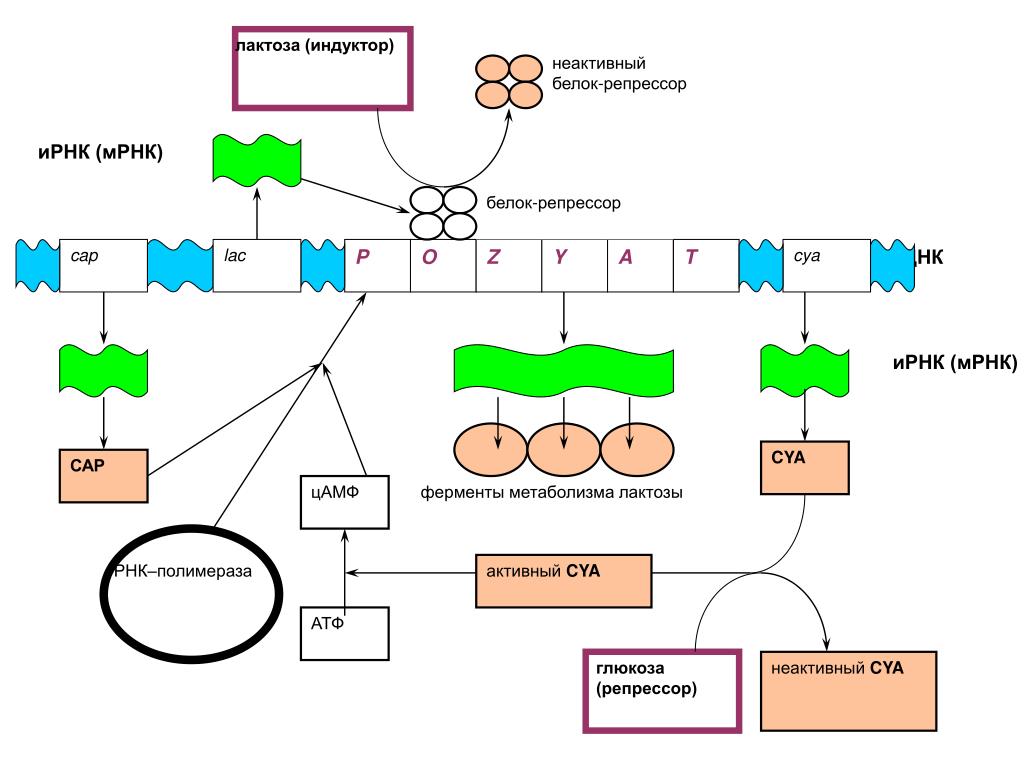 А значит, увидеть друг друга не смогут только пять процентов потенциальных пользователей. Остальные окажутся совместимы друг с другом.
А значит, увидеть друг друга не смогут только пять процентов потенциальных пользователей. Остальные окажутся совместимы друг с другом.
Семейные мутации
«ДНК-тестирование на совместимость пары имеет смысл при наличии наследственных болезней в семье одного из партнеров. В геноме каждого человека есть пять-семь скрытых мутаций, ответственных за развитие аутосомно-рецессивных заболеваний. То есть чтобы проявилась клиническая картина болезни, необходима встреча двух людей с одинаковыми повреждениями в одном и том же гене. Вероятность рождения ребенка с наследственной патологией у такой пары составляет 25 процентов, что считается высоким генетическим риском. При известном семейном характере наследственного заболевания пара имеет все шансы на рождение здорового потомства, тем более что современные репродуктивные технологии позволяют обходить многие генетические особенности», — пояснила РИА Новости эксперт Центра молекулярной диагностики ЦНИИ эпидемиологии Роспотребнадзора, врач лабораторной генетики Екатерина Антипова.
Кроме того, сегодня также известны гены, вариации в которых могут играть роль в развитии некоторых особенностей поведения. Это, в свою очередь, скажется и на отношениях внутри семьи.
8 декабря 2017, 11:20НаукаУченые сравнили любовь с первого взгляда и крепкие семейные отношения
«Вариации в гене транспортера серотонина способны влиять на ощущение удовлетворенности жизнью. Носители коротких аллелей этого гена больше склонны к тревожности, стрессам и депрессиям. Людям, ДНК которых содержит его длинные версии, чаще свойственны оптимизм и положительная обработка информации. Также на модель человеческого поведения способны влиять полиморфизмы — вариации — в генах дофаминового рецептора и рецептора окситоцина. Первые связаны с проявлением более агрессивного, импульсивного поведения. Вторые — с повышенной эмпатией и стрессоустойчивостью. Таким образом, принимая во внимание генетические аспекты, мы можем прогнозировать особенности поведения в семейной жизни. Но не надо забывать, что полиморфизм определяет только предрасположенность. А ее развитие зависит от условий внешней среды и образа жизни», — подчеркнула Екатерина Антипова.
А ее развитие зависит от условий внешней среды и образа жизни», — подчеркнула Екатерина Антипова.
Провериться на совместимость
По мнению американских и британских исследователей, залог прочного брака — правильная версия гена OXTR, связанного с синтезом окситоцина — гормона, регулирующего чувство тревоги. Проверив ДНК 178 супружеских пар, ученые выяснили: если один из супругов — носитель GG-генотипа (определенного варианта OXTR), оба партнера будут удовлетворены семейной жизнью. Люди, в чьей ДНК есть эта версия гена, редко испытывают тревожную привязанность к партнеру. А значит, они меньше страдают от низкой самооценки и не нуждаются в постоянном одобрении всех своих действий.Впрочем, авторы работы не советуют при выборе мужа или жены ориентироваться на результаты их исследования. Во-первых, одни и те же гены способны одновременно влиять на огромное количество признаков, и трудно предсказать, как еще GG-генотип проявится в поведении человека. Во-вторых, ни один признак не определяется мутацией в единственном гене. Исключение — наследственные болезни, для развития которых достаточно получить по одной версии поврежденного гена от каждого родителя.2 апреля 2019, 08:00НаукаМир без анонимности и семейных тайн. Трагические последствия ДНК-тестов
Исключение — наследственные болезни, для развития которых достаточно получить по одной версии поврежденного гена от каждого родителя.2 апреля 2019, 08:00НаукаМир без анонимности и семейных тайн. Трагические последствия ДНК-тестов
«Если в будущем перед походом в загс молодые люди станут посещать врача-генетика, то, скорее всего, речь пойдет о выявлении мутаций, вызывающих самые частые аутосомно-рецессивные заболевания. Кроме того, можно будет провести анализ кариотипа и совместимости по HLA-антигенам II класса. Все мы отличаемся по этим антигенам. Ребенок получает половину от мамы, половину от папы. В начале беременности чужеродные для организма матери отцовские антигены плода вызывают выработку специальных антител. Они, в свою очередь, защищают эмбрион от клеток материнской иммунной системы (натуральных киллеров). В результате беременность протекает нормально. Если же у родителей совпадают четыре и более антигена HLA II класса, вырабатывается меньше защитных антител или же этого не происходит вовсе. В этом случае иммунная система матери расценивает развивающийся плод как скопление опухолевых клеток и старается его уничтожить. Поэтому, зная об индивидуальных генетических особенностях заранее, люди будут готовы к некоторым возможным трудностям. А их благодаря развитию современных репродуктивных технологий вполне можно обойти», — пояснила Екатерина Антипова.
В этом случае иммунная система матери расценивает развивающийся плод как скопление опухолевых клеток и старается его уничтожить. Поэтому, зная об индивидуальных генетических особенностях заранее, люди будут готовы к некоторым возможным трудностям. А их благодаря развитию современных репродуктивных технологий вполне можно обойти», — пояснила Екатерина Антипова.
Вакансии компании Центр Генетики и Репродуктивной Медицины ГЕНЕТИКО
Центр Генетики и Репродуктивной Медицины «ГЕНЕТИКО» — это комплекс лабораторий, оказывающий широкий спектр медико-генетических услуг как для врачей, так и для пациентов.
В состав комплекса «ГЕНЕТИКО» входят четыре лаборатории:
- Лаборатория молекулярной генетики — специалисты этой лаборатории разрабатывают и реализуют генетические тесты, направленные на выявление носительства моногенных заболеваний, поиск генетических факторов бесплодия, оценку вероятности развития онкологий, диагностику моногенных заболеваний как у взрослых, так и у детей, а при необходимости – в рамках пренатальной диагностики.
- Лаборатория NGS (next generation sequencing). Секвенирование нового поколения — это универсальный инструмент для анализа ДНК в больших масштабах. Он позволяет узнать последовательность как нескольких генов, так и всего генома человека с высокой точностью и скоростью, поэтому в настоящее время все чаще используется для генетического анализа. Лаборатория NGS занимается генетическими тестами, основанными на этой технологии: поиск мутаций в генах, связанных с определенной группой наследственных заболеваний, секвенирование генома, экзома (только кодирующей части генома) и клинического экзома (кодирующей части тех генов, мутации в которых приводят к наследственным заболеваниям), пренатальный генетический скрининг хромосомных аномалий (ПГС).
- Лаборатория неинвазивной пренатальной диагностики. Неинвазивный пренатальный тест (НИПТ) предназначен для женщин, начиная с 10 недели беременности. На сегодняшний день данное исследование рекомендовано проводить после комбинированного биохимического скрининга и ультразвукового исследования, по результатам которых выявлен высокий риск наличия основных хромосомных аномалий у плода (синдромы Дауна, Эдвардса, Патау, анеуплоидии по половым хромосомам). Тест Prenetix, обладает более высокой точностью выявления хромосомных патологий и позволяет избежать неоправданных инвазивных процедур. Только в случае обнаружения высокого риска хромосомной патологии пациенту следует пройти подтверждающую диагностику методами биопсии хориона, амнио- и/или кордоцентеза. Выполняемый тест осуществляется по технологии Harmony компании Roche (Ariosa), точность которой подтверждена множеством публикаций и исследований.
- Лаборатория хромосомного микроматричного анализа. Хромосомный микроматричный анализ направлен на выявление аномалий в геноме, связанных с изменением количества различных участков хромосом – делеций и дупликаций. Такой анализ возможно проводить как взрослым людям, так и для установления причин самопроизвольного выкидыша и замершей беременности.
Важным направлением работы Genetico является диагностика генетически обусловленного бесплодия и повышение эффективности вспомогательных репродуктивных технологий (ЭКО). В ряде случаев нам удается выявить генетические причины «бесплодия неясного генеза» и помочь паре стать родителями.
Для проведения анализов в лаборатории Genetico используются только технологии, доказавшие свою точность и надежность, в том числе – гибридизация на микрочипах и секвенирование нового поколения (next generation sequencing, NGS). Точность результатов обеспечивается также внедренной в практику «двойной проверкой» — каждый анализ перед выдачей пациенту проверяется двумя специалистами.
Помимо генетических анализов, Центр Генетики и Репродуктивной Медицины оказывает услуги медико-генетического консультирования для пациентов как в нашей лаборатории, так и в медицинских учреждениях.
Обращение к врачу-генетику становится наиболее актуальным при отягощении семейной истории случаями наследственной патологии, при кровном родстве супругов, при бесподии или невынашивании беременности в паре, при нарушении половой дифференцировки, при наличии отставания психоречевого или моторного развития у ребенка и пр.
Также, консультирование врача-генетика рекомендуется для профилактики с целью выявления рисков (например, онкогенетических). В таких случаях, пациент совместно с врачом вырабатывают стратегию предупреждения возможных проблем.
В Центре Генетики и Репродуктивной Медицины был разработан и успешно используется ряд комплексных генетических обследований, предназначенных специально для жителей России. Программы этих обследований составлялись с учетом местной специфики, поэтому в них вошли только те мутации, которые достаточно широко распространены в нашей популяции.
Непрерывные генетические алгоритмы — математический аппарат
Немного истории
Генетические алгоритмы (ГА) – это мощный инструмент для решения сложных задач. Они нашли применение в оптимизации, искусственном интеллекте, инженерии и других областях. В основе ГА лежат принципы, заимствованные из биологии и генетики. Напомним: основная идея ГА состоит в создании популяции особей (индивидов), каждая из которых представляется в виде хромосомы. Любая хромосома есть возможное решение рассматриваемой оптимизационной задачи. Для поиска лучших решений необходимо только значение целевой функции, или функции приспособленности. Значение функции приспособленности особи показывает, насколько хорошо подходит особь, описанная данной хромосомой, для решения задачи. Хромосома состоит из конечного числа генов, представляя генотип объекта, т.е. совокупность его наследственных признаков. Процесс эволюционного поиска ведется только на уровне генотипа. К популяции применяются основные биологические операторы: скрещивания, мутации, инверсии и др. В процессе эволюции действует известный принцип «выживает сильнейший». Популяция постоянно обновляется при помощи генерации новых особей и уничтожения старых, и каждая новая популяция становится лучше и зависит только от предыдущей.
Фиксированная длина хромосомы и кодирование строк двоичным алфавитом преобладали в теории ГА с момента начала ее развития, когда были получены теоретические результаты о целесообразности использования именно двоичного алфавита (подробнее о математическом аппарате ГА с двоичными хромосомами читайте в первом материале этого цикла). К тому же, реализация такого ГА на ЭВМ была сравнительно легкой. Все же, небольшая группа исследователей шла по пути применения в ГА отличных от двоичных алфавитов для решения частных прикладных задач. Одной из таких задач является нахождение решений, представленных в форме вещественных чисел, что называется не иначе как «поисковая оптимизация в непрерывных пространствах». Возникла следующая идея: решение в хромосоме представлять напрямую в виде набора вещественных чисел. Естественно, что потребовались специальные реализации биологических операторов. Такой тип генетического алгоритма получил название непрерывного ГА (real-coded GA), или генетического алгоритма с вещественным кодированием.
Первоначально непрерывные гены стали использоваться в специфических приложениях (например, хемометрика, оптимальный подбор параметров операторов стандартных ГА и др.). Позднее они начинают применяться для решения других задач оптимизации в непрерывных пространствах (работы исследователей Wright, Davis, Michalewicz, Eshelman, Herrera в 1991-1995 гг). Поскольку до 1991 теоретических обоснований работы непрерывных ГА не существовало, использование этого нового подвида было спорным; ученые, знакомые с фундаментальной теорией эволюционных вычислений, в которой было доказано превосходство двоичного алфавита перед другими, критически воспринимали успехи real-coded алгоритмов. После того, как спустя некоторое время теоретическое обоснование появилось, непрерывные ГА полностью вытеснили двоичные хромосомы при поиске в непрерывных пространствах.
Далее в тексте по аналогии с англоязычной терминологией для ГА с двоичным кодированием будет использоваться аббревиатура BGA (Binary coded), для ГА с непрерывными генами – RGA (Real coded).
Преимущества и недостатки двоичного кодирования
Прежде чем излагать особенности математического аппарата непрерывных ГА, остановимся на анализе достоинств и недостатков двоичной схем кодирования.
Как известно, высокая эффективность отыскания глобального минимума или максимума генетическим алгоритмом с двоичным кодированием теоретически обоснована в фундаментальной теореме генетических алгоритмов («теореме о шаблоне»), доказанной Холландом.1000$ хромосом.
Эффективность BGA в этом случае будет невысокой. На первых итерациях алгоритм потратит много усилий на оценку младших разрядов числа, закодированных во фрагменте двоичной хромосомы. Но оптимальное значение на первых итерациях будет зависеть от старших разрядов числа. Следовательно, пока в процессе эволюции алгоритм не выйдет на значение старшего разряда в окрестности оптимума, операции с младшими разрядами окажутся бесполезными. С другой стороны, когда это произойдет, станут не нужны операции со старшими разрядами – необходимо улучшать точность решения поиском в младших разрядах. Такое «идеальное» поведение не обеспечивает семейство алгоритмов BGA, т.к. эти алгоритмы оперируют битовой строкой целиком, и на первых же эпохах младшие разряды чисел «застывают», принимая случайное значение. В классических ГА разработаны специальные приемы по выходу из этой ситуации. Например, последовательный запуск ансамбля генетических алгоритмов с постепенным сужением пространства поиска.
Есть и другая проблема: при увеличении длины битовой строки необходимо увеличивать и численность популяции.
Математический аппарат непрерывных ГА
Как уже отмечалось, при работе с оптимизационными задачами в непрерывных пространствах вполне естественно представлять гены напрямую вещественными числами. В этом случае хромосома есть вектор вещественных чисел. Их точность будет определяться исключительно разрядной сеткой той ЭВМ, на которой реализуется real-coded алгоритм. Длина хромосомы будет совпадать с длиной вектора-решения оптимизационной задачи, иначе говоря, каждый ген будет отвечать за одну переменную. Генотип объекта становится идентичным его фенотипу.
Вышесказанное определяет список основных преимуществ real-coded алгоритмов:
- Использование непрерывных генов делает возможным поиск в больших пространствах (даже в неизвестных), что трудно делать в случае двоичных генов, когда увеличение пространства поиска сокращает точность решения при неизменной длине хромосомы.
- Одной из важных черт непрерывных ГА является их способность к локальной настройке решений.
- Использование RGA для представления решений удобно, поскольку близко к постановке большинства прикладных задач. Кроме того, отсутствие операций кодирования/декодирования, которые необходимы в BGA, повышает скорость работы алгоритма.
Как известно, появление новых особей в популяции канонического ГА обеспечивают несколько биологических операторов: отбор, скрещивание и мутация. В качестве операторов отбора особей в родительскую пару здесь подходят любые известные из BGA: рулетка, турнирный, случайный. Однако операторы скрещивания и мутации не годятся: в классических реализациях они работают с битовыми строками. Нужны собственные реализации, учитывающие специфику real-coded алгоритмов.
Оператор скрещивания непрерывного ГА, или кроссовер, порождает одного или нескольких потомков от двух хромосом. Собственно говоря, требуется из двух векторов вещественных чисел получить новые векторы по каким-либо законам.b]$
Сложно сказать, что более эффективно в каждом конкретном случае, но многочисленные исследования доказывают, что непрерывные ГА не менее эффективно, а часто гораздо эффективнее справляются с задачами оптимизации в многомерных пространствах, при этом более просты в реализации из-за отсутствия процедур кодирования и декодирования хромосом.
Рассмотренные кроссоверы исторически были предложены первыми, однако во многих задачах их эффективность оказывается невысокой. Исключение составляет BLX-кроссовер с параметром alpha=0.5 – он превосходит по эффективности большинство простых кроссоверов. Позднее были разработаны улучшенные операторы скрещивания, аналитическая формула которых и эффективность обоснованы теоретически. Рассмотрим подробнее один из таких кроссоверов – SBX.
SBX кроссовер
SBX (англ.: Simulated Binary Crossover) – кроссовер, имитирующий двоичный. Был разработан в 1995 году исследовательской группой под руководством K. Deb’а. Как следует из его названия, этот кроссовер моделирует принципы работы двоичного оператора скрещивания.{\frac{1}{n+1}}, u(0,1)> 0,5.
\end{cases}$
В формуле $u(0,1)$ – случайное число, распределенное по равномерному закону, $n[2,5]$ – параметр кроссовера.
На рисунке приведена геометрическая интерпретация работы SBX кроссовера при скрещивании двух хромосом, соответствующих вещественным числам 2 и 5. Видно, как параметр n влияет на конечный результат: увеличение n влечет за собой увеличение вероятности появления потомка в окрестности родителя и наоборот.
Эксперименты автора SBX кроссовера показали, что он во многих случаях эффективнее BLX, хотя, очевидно, что не существует ни одного кроссовера, эффективного во всех случаях. Исследования показывают, что использование нескольких различных операторов кроссовера позволяет уменьшить вероятность преждевременной сходимости, т.е. улучшить эффективность алгоритма оптимизации в целом. Для этого могут использоваться специальные стратегии, изменяющие вероятность применения отдельного эволюционного оператора в зависимости от его «успешности», или использование гибридных кроссоверов, которых в настоящее время насчитывается несколько десятков. В любом случае, если перед Вами стоит задача оптимизации в непрерывных пространствах, и Вы планируете применить эволюционные техники, то следует сделать выбор в пользу непрерывного генетического алгоритма.
Литература
- Herrera F., Lozano M., Verdegay J.L. Tackling real-coded Genetic algorithms: operators and tools for the behaviour analysis // Artificial IntelligenceReview, Vol. 12, No. 4, 1998. – P. 265-319.
- Herrera F., Lozano M., Sanchez A.M. Hybrid Crossover Operators for Real-Coded Genetic Algorithms: An Experimental Study // Soft Comput. 9(4): 280-298 (2005).
- Wright A. Genetic algorithms for real parameter optimization // Foundations of Genetic Algorithms, V. 1. – 1991. – P. 205-218.
- Deb, K. and Kumar, A. (1995). Realcoded genetic algorithms with simulated binary crossover: Studies on multimodal and multiobjective problems. Complex Systems, 9(6), 431—454.
«Мы не боги, мы программисты». Ученые научились сохранять информацию напрямую в ДНК
- Николай Воронин
- Корреспондент по вопросам науки
Автор фото, IMDB
«Джиу-джитсу? Меня научат джиу-джитсу?!» — герой Киану Ривза недоверчиво смотрит на оператора. Тот лишь подмигивает в ответ, пробегает пальцами по клавишам — и лицо Избранного искажает гримаса невыносимой боли. Однако приступ оказывается недолгим: уже через пару секунд он с трудом отрывает голову от кресла и восхищенно выдыхает: «Я знаю кунг-фу!»
Знаменитая сцена из фильма «Матрица» может оказаться не так далека от реальности, как всем нам казалось еще каких-то 20 лет назад.
Американские ученые из Колумбийского университета в Нью-Йорке разработали технологию, позволяющую копировать информацию с любого цифрового носителя напрямую в ДНК, фактически превращая клетки живых организмов в миниатюрные устройства для записи и хранения данных.
Конечно, изучать таким образом боевые искусства в ближайшем будущем вряд ли станет возможным, но у новой технологии есть масса других возможных применений.
Например, если загрузить компьютерный код в ДНК какой-нибудь кишечной палочки, это никак не отразится на ее способности к размножению. А значит, такие «ожившие программы» могут самым естественным образом бесконечно штамповать собственные копии в чашке Петри, непрерывно обновляя зашифрованный в них код.
Другими словами — тысячелетия хранить нужную информацию в почти неизменном виде.
Пока что новая технология сильно уступает другим, привычным методам хранения данных — как по скорости, так и по объему записывающих устройств. Однако, по словам ученых, она надежно защищена от ошибок, ведь система записи генетической информации — без всякого преувеличения — стара как сама жизнь.
Как это работает?
Сама по себе технология сборки ДНК не нова. Азотистых оснований, из которых состоит генетический код, всего четыре. В лабораторных условиях их можно собирать в цепочку, нанизывая одно за другим, как бусы, в произвольном порядке.
Делается это при помощи технологии CRISPR-Cas9, более известной как «генетические ножницы». Она была разработана восемь лет назад, а в прошлом году была удостоена Нобелевской премии по химии.
Однако сборка генетического кода на молекулярном уровне — работа кропотливая: она требует массы времени и специального оборудования. Во всяком случае так было до последнего времени, пока группе ученых из Колумбийского университета не удалось автоматизировать этот процесс.
Автор фото, Getty Images
«Нам удалось научить клетки разговаривать с компьютером посредством электронных сигналов и таким образом скачивать информацию с любого электронного носителя», — рассказывает Би-би-си ведущий автор исследования, профессор системной биологии Харрис Ванг (Harris Wang).
Опыты проводились в его лаборатории, с использованием кишечной палочки E. coli. Эта бактерия настолько хорошо изучена, что микробиологи часто использую ее клетки в своих экспериментах в качестве подопытных кроликов.
Однако, подчеркивает профессор, CRISPR отлично подходит и для редактирования человеческого генома. А значит, можно надеяться, что в будущем информацию можно будет копировать из компьютера напрямую в клетки людей. Почти как в «Матрице» или в фильме «Джонни-мнемоник» все с тем же Киану Ривзом в главной роли.
Автор фото, Columbia TriStar
«Двоичный код компьютерной программы (набор нолей и единиц) мы переводим в электрические импульсы, которые посылаем в клетку, — объясняет изобретатель. — На ее поверхности есть рецепторы, которые воспринимают эти сигналы и уже переводят их на язык ДНК, автоматически выстраивая нужную последовательность генома».
В результате к основной цепочке ДНК добавляется дополнительный фрагмент — своеобразный «информационный прицеп». В отличие от цифровой компьютерной информации, он представляет собой набор букв генетического кода (то есть аналоговый шифр), поэтому ученый сравнивает этот отрезок с магнитной лентой.
Зашитая в ДНК бактерии информация становится частью ее генома и автоматически копируется при каждом делении клетки.
«А это значит, что позже, считав эту последовательность, мы сможем восстановить, воссоздать информацию, сохраненную в популяции клеток», — утверждает профессор.
Автор фото, Columbia University
Как два байта записать?
Изначально эксперимент проводился для того, чтобы автоматизировать сложный процесс сборки ДНК и сделать его более доступным — не требующим специальных знаний и оборудования.
Однако, по словам профессора Университета центральной Флориды в Орландо Дмитрия Колпащикова, использовать длинные фрагменты ДНК для записи информации довольно неэффективно. Общепринятый способ — когда при сборке в лаборатории каждое звено полимерной цепочки ДНК кодирует один или даже несколько битов информации — куда более эффективен.
«Чтобы записать один бит информации, в клетку посылали электрические сигналы на протяжении 14 часов, — недоумевает он. — Чтобы найти этой технологии хоть какое-то практическое применение, процесс необходимо сильно ускорить. Притом что очевидных способов сократить это время нет: на запись одного бита будет уходить в лучшем случае час, а то и несколько».
В ходе эксперимента, продолжавшегося 42 часа, ученым удалось записать в ДНК всего три бита информации.
А ведь чтобы считать эту информацию в будущем, необходимо провести полную расшифровку бактериальной ДНК — что при нынешнем уровне технологий, конечно, не то чтобы сложно, но все же требует значительного времени и средств: секвенирование генома стоит недешево.
Профессор Ванг говорит, что в лаборатории процесс замедляли специально, а плотность записи информации в формате ДНК теоретически может быть даже выше, чем позволяют существующие технологии. Не говоря уже о том, что клеточное строительство едва ли уступает по скорости цифровой записи.
Автор фото, Columbia University
«Время компьютерных операций измеряется в миллисекундах, но некоторые клеточные энзимы могут работать столь же быстро, — уверяет он. — Возможно, в будущем мы сможем разработать какие-то внутриклеточные механизмы, которые позволят сильно ускорить процесс. Теоретически ничто не мешает создать клетку, которая будет полностью копировать свой геном за несколько минут».
Однако, по словам Колпащикова, даже в этом случае предлагаемый американцами метод вряд ли окажется более эффективным, чем уже существующие сегодня способы записи информации. Так что даже развивать новую технологию особого смысла нет — если, конечно, речь только о способе хранения данных.
Однако ей вполне можно найти другое применение.
Неподвластные времени
Искусственно собранные цепочки генетического кода используются для самых разных целей. Например, в лаборатории, которой руководит Колпащиков, из так называемой компьютированной ДНК собирают наномашины для терапии раковых заболеваний, гриппа, а также проведения опытов в области генной инженерии.
Если процесс сборки удастся автоматизировать и ускорить, то разработанная американцами технология может оказаться весьма востребованной. Ведь так или иначе она позволяет установить прямой канал передачи данных между привычными нам компьютерами и живыми клетками.
И хотя пока канал этот и не самый быстрый и надежный, по словам профессора Ванга, у нее есть еще одно очень важное преимущество.
«В ДНК информация записана в трехмерном аналоговом виде, а это наиболее устойчивая форма. В таком виде данные могут храниться сотни тысяч, а то и миллионы лет», — уверяет он.
Уже сегодня иногда не так просто найти способ, чтобы считать данные с лазерного диска или магнитной ленты, не говоря уж о перфокартах.
Все эти носители недолговечны, а любые технологии быстро устаревают, напоминает профессор. А вот генетическому коду эта проблема нипочем.
Автор фото, Science Photo Library
Подпись к фото,
Перфокарты или магнитные носители
«Мы знаем, что и через 50 тысяч лет сможем расшифровать ДНК ровно так же, как делаем это сегодня, — уверен Харрис Ванг. — Какая еще форма записи на такое способна?»
С этим Колпащиков не спорит: «Фактически [за счет репродукции] идет биологическая поддержка жизнеспособности бактерий — несмотря на то, что там могут накапливаться ошибки. В целом, я согласен: это хороший аргумент».
По поводу возможных ошибок разработчики настроены оптимистично. По их словам, никто не собирается выпускать бактерии с «информационным прицепом» во внешнюю среду, где им придется бороться за выживание — так что естественный отбор им не грозит.
«Интересная разработка»
Профессор Ванг не спорит, что пока технология находится на самом начальном этапе разработки. В идеале нужно как-то автоматизировать и обратный процесс: сделать так, чтобы клетка могла не только копировать и сохранять информацию, но и самостоятельно передавать ее куда-то. Только тогда она научится полноценно «разговаривать с компьютером» — не только слушать, но и отвечать.
Впрочем до этого, признает разработчик, еще очень и очень далеко. Природа изобрела массу способов, позволяющих создавать и изменять генетический код, а ученые только начинают их осваивать.
Автор фото, Columbia University
«Мы не боги, — улыбается профессор, — Мы лишь используем ДНК для записи информации. Так что мы скорее художники, или писатели, или программисты — создаем генетические программы с каким-то новым полезным функционалом из уже готовых элементов».
Следующий шаг, по его словам, — упростить способ передачи информации из компьютера в клетку. Сейчас для этого используется поток электронов, но в будущем его можно заменить чем-нибудь другим. Например, переменным магнитным полем или температурой внешней среды. Или даже обычным лучом света — ведь фоторецепторы есть у большинства живых организмов.
Тогда, мечтает профессор, копировать информацию в ДНК можно будет куда быстрее — ведь запись можно будет одновременно вести сразу на нескольких частотах.
Впрочем, у Дмитрия Колпащикова есть сомнения по поводу того, насколько надежной будет такая передача данных. По его словам, похожие технологии (когда из одного источника идет параллельная запись на волнах разной длины) уже используются в медицинской диагностике. Но это, как он считает, не самое перспективное направление.
«Почему в компьютерном коде используется двоичная система — нули и единицы? Потому что это самая надежная запись, — размышляет эксперт. — Если мы переходим на другой уровень, то начинают накапливаться ошибки. Именно поэтому в реальных приборах очень сложно уйти от двоичной системы — риск ошибиться слишком велик».
«В общем, хранение данных — не основное направление для [технологий компьютированной] ДНК, — резюмирует он. — Это действительно шаг в сторону. Насколько успешным он будет, неизвестно — но разработка эта, безусловно, интересная и необычная».
Всероссийский урок генетики
Ежегодно 25 апреля в разных странах мира отмечается Международный день ДНК. В рамках этого праздника 23 апреля в ГАПОУ «Волгоградский медицинский колледж» состоялся Всероссийский урок генетики по теме: » Генетика: история и будущее». Данный урок прошел в рамках Дней единых действий, проводимых ФГБОУ ДО «Федеральный детский эколого – биологический центр» совместно с Министерством просвещения РФ и был направлен на развитие устойчивого познавательного интереса к изучению генетики.
В ходе урока преподаватели биологии Ермолова Ольга Михайловна, Сидорова Людмила Алексеевна, Николаева Елена Павловна и Егорова Анастасия Александровна познакомили студентов 1 курса специальностей Сестринское дело, Акушерское дело, Лабораторная диагностика с современными генетическими технологиями, перспективами развития генетики в Российской Федерации. Студенты совершили виртуальную экскурсию в генетическую лабораторию и познакомились с методом сенквенирования молекулы ДНК.
array(51) {
["ID"]=>
string(4) "1475"
["~ID"]=>
string(4) "1475"
["NAME"]=>
string(52) "Всероссийский урок генетики"
["~NAME"]=>
string(52) "Всероссийский урок генетики"
["IBLOCK_ID"]=>
string(2) "14"
["~IBLOCK_ID"]=>
string(2) "14"
["IBLOCK_SECTION_ID"]=>
NULL
["~IBLOCK_SECTION_ID"]=>
NULL
["DETAIL_TEXT"]=>
string(938) "
В ходе урока преподаватели биологии Ермолова Ольга Михайловна, Сидорова Людмила Алексеевна, Николаева Елена Павловна и Егорова Анастасия Александровна познакомили студентов 1 курса специальностей Сестринское дело, Акушерское дело, Лабораторная диагностика с современными генетическими технологиями, перспективами развития генетики в Российской Федерации. Студенты совершили виртуальную экскурсию в генетическую лабораторию и познакомились с методом сенквенирования молекулы ДНК.
"
["~DETAIL_TEXT"]=>
string(938) "
В ходе урока преподаватели биологии Ермолова Ольга Михайловна, Сидорова Людмила Алексеевна, Николаева Елена Павловна и Егорова Анастасия Александровна познакомили студентов 1 курса специальностей Сестринское дело, Акушерское дело, Лабораторная диагностика с современными генетическими технологиями, перспективами развития генетики в Российской Федерации. Студенты совершили виртуальную экскурсию в генетическую лабораторию и познакомились с методом сенквенирования молекулы ДНК.
"
["DETAIL_TEXT_TYPE"]=>
string(4) "html"
["~DETAIL_TEXT_TYPE"]=>
string(4) "html"
["PREVIEW_TEXT"]=>
string(941) "
Ежегодно 25 апреля в разных странах мира отмечается Международный день ДНК. В рамках этого праздника 23 апреля в ГАПОУ «Волгоградский медицинский колледж» состоялся Всероссийский урок генетики по теме: " Генетика: история и будущее". Данный урок прошел в рамках Дней единых действий, проводимых ФГБОУ ДО «Федеральный детский эколого – биологический центр» совместно с Министерством просвещения РФ и был направлен на развитие устойчивого познавательного интереса к изучению генетики.
"
["~PREVIEW_TEXT"]=>
string(941) "
Ежегодно 25 апреля в разных странах мира отмечается Международный день ДНК. В рамках этого праздника 23 апреля в ГАПОУ «Волгоградский медицинский колледж» состоялся Всероссийский урок генетики по теме: " Генетика: история и будущее". Данный урок прошел в рамках Дней единых действий, проводимых ФГБОУ ДО «Федеральный детский эколого – биологический центр» совместно с Министерством просвещения РФ и был направлен на развитие устойчивого познавательного интереса к изучению генетики.
"
["PREVIEW_TEXT_TYPE"]=>
string(4) "html"
["~PREVIEW_TEXT_TYPE"]=>
string(4) "html"
["DETAIL_PICTURE"]=>
array(19) {
["ID"]=>
string(4) "3368"
["TIMESTAMP_X"]=>
object(Bitrix\Main\Type\DateTime)#195 (1) {
["value":protected]=>
object(DateTime)#196 (3) {
["date"]=>
string(26) "2021-04-28 08:24:31.000000"
["timezone_type"]=>
int(3)
["timezone"]=>
string(13) "Europe/Moscow"
}
}
["MODULE_ID"]=>
string(6) "iblock"
["HEIGHT"]=>
string(3) "300"
["WIDTH"]=>
string(3) "300"
["FILE_SIZE"]=>
string(5) "18583"
["CONTENT_TYPE"]=>
string(10) "image/jpeg"
["SUBDIR"]=>
string(10) "iblock/4ca"
["FILE_NAME"]=>
string(36) "4ca3532196268a4c3c54d1a8271267ea.jpg"
["ORIGINAL_NAME"]=>
string(5) "1.jpg"
["DESCRIPTION"]=>
string(0) ""
["HANDLER_ID"]=>
NULL
["EXTERNAL_ID"]=>
string(32) "cec9c089a0ee2f0e9af6341a329dfa15"
["~src"]=>
bool(false)
["SRC"]=>
string(55) "/upload/iblock/4ca/4ca3532196268a4c3c54d1a8271267ea.jpg"
["UNSAFE_SRC"]=>
string(55) "/upload/iblock/4ca/4ca3532196268a4c3c54d1a8271267ea.jpg"
["SAFE_SRC"]=>
string(55) "/upload/iblock/4ca/4ca3532196268a4c3c54d1a8271267ea.jpg"
["ALT"]=>
string(52) "Всероссийский урок генетики"
["TITLE"]=>
string(52) "Всероссийский урок генетики"
}
["~DETAIL_PICTURE"]=>
string(4) "3368"
["TIMESTAMP_X"]=>
string(19) "28.04.2021 08:24:31"
["~TIMESTAMP_X"]=>
string(19) "28.04.2021 08:24:31"
["ACTIVE_FROM"]=>
string(10) "25.04.2021"
["~ACTIVE_FROM"]=>
string(10) "25.04.2021"
["LIST_PAGE_URL"]=>
string(6) "/news/"
["~LIST_PAGE_URL"]=>
string(6) "/news/"
["DETAIL_PAGE_URL"]=>
string(11) "/news/1475/"
["~DETAIL_PAGE_URL"]=>
string(11) "/news/1475/"
["LANG_DIR"]=>
string(1) "/"
["~LANG_DIR"]=>
string(1) "/"
["CODE"]=>
string(27) "Vserossiyskiy_urok_genetiki"
["~CODE"]=>
string(27) "Vserossiyskiy_urok_genetiki"
["EXTERNAL_ID"]=>
string(4) "1475"
["~EXTERNAL_ID"]=>
string(4) "1475"
["IBLOCK_TYPE_ID"]=>
string(4) "news"
["~IBLOCK_TYPE_ID"]=>
string(4) "news"
["IBLOCK_CODE"]=>
string(22) "bitrix_edusite_news_s1"
["~IBLOCK_CODE"]=>
string(22) "bitrix_edusite_news_s1"
["IBLOCK_EXTERNAL_ID"]=>
string(22) "bitrix_edusite_news_s1"
["~IBLOCK_EXTERNAL_ID"]=>
string(22) "bitrix_edusite_news_s1"
["LID"]=>
string(2) "s1"
["~LID"]=>
string(2) "s1"
["NAV_RESULT"]=>
bool(false)
["DISPLAY_ACTIVE_FROM"]=>
string(10) "25.04.2021"
["IPROPERTY_VALUES"]=>
array(0) {
}
["FIELDS"]=>
array(0) {
}
["PROPERTIES"]=>
array(2) {
["MAIN"]=>
array(37) {
["ID"]=>
string(2) "98"
["TIMESTAMP_X"]=>
string(19) "2019-12-09 13:58:41"
["IBLOCK_ID"]=>
string(2) "14"
["NAME"]=>
string(40) "Главная новость сайта"
["ACTIVE"]=>
string(1) "Y"
["SORT"]=>
string(3) "500"
["CODE"]=>
string(4) "MAIN"
["DEFAULT_VALUE"]=>
string(0) ""
["PROPERTY_TYPE"]=>
string(1) "L"
["ROW_COUNT"]=>
string(1) "1"
["COL_COUNT"]=>
string(2) "30"
["LIST_TYPE"]=>
string(1) "C"
["MULTIPLE"]=>
string(1) "N"
["XML_ID"]=>
string(1) "7"
["FILE_TYPE"]=>
string(0) ""
["MULTIPLE_CNT"]=>
string(1) "5"
["TMP_ID"]=>
NULL
["LINK_IBLOCK_ID"]=>
string(1) "0"
["WITH_DESCRIPTION"]=>
string(1) "N"
["SEARCHABLE"]=>
string(1) "N"
["FILTRABLE"]=>
string(1) "N"
["IS_REQUIRED"]=>
string(1) "N"
["VERSION"]=>
string(1) "1"
["USER_TYPE"]=>
NULL
["USER_TYPE_SETTINGS"]=>
NULL
["HINT"]=>
string(0) ""
["PROPERTY_VALUE_ID"]=>
NULL
["VALUE"]=>
string(0) ""
["DESCRIPTION"]=>
string(0) ""
["VALUE_ENUM"]=>
NULL
["VALUE_XML_ID"]=>
NULL
["VALUE_SORT"]=>
NULL
["VALUE_ENUM_ID"]=>
NULL
["~VALUE"]=>
string(0) ""
["~DESCRIPTION"]=>
string(0) ""
["~NAME"]=>
string(40) "Главная новость сайта"
["~DEFAULT_VALUE"]=>
string(0) ""
}
["GALLERY"]=>
&array(36) {
["ID"]=>
string(3) "548"
["TIMESTAMP_X"]=>
string(19) "2020-03-24 10:02:49"
["IBLOCK_ID"]=>
string(2) "14"
["NAME"]=>
string(14) "Галерея"
["ACTIVE"]=>
string(1) "Y"
["SORT"]=>
string(3) "500"
["CODE"]=>
string(7) "GALLERY"
["DEFAULT_VALUE"]=>
string(0) ""
["PROPERTY_TYPE"]=>
string(1) "F"
["ROW_COUNT"]=>
string(1) "1"
["COL_COUNT"]=>
string(2) "30"
["LIST_TYPE"]=>
string(1) "L"
["MULTIPLE"]=>
string(1) "Y"
["XML_ID"]=>
NULL
["FILE_TYPE"]=>
string(24) "jpg, gif, bmp, png, jpeg"
["MULTIPLE_CNT"]=>
string(1) "5"
["TMP_ID"]=>
NULL
["LINK_IBLOCK_ID"]=>
string(1) "0"
["WITH_DESCRIPTION"]=>
string(1) "N"
["SEARCHABLE"]=>
string(1) "N"
["FILTRABLE"]=>
string(1) "N"
["IS_REQUIRED"]=>
string(1) "N"
["VERSION"]=>
string(1) "1"
["USER_TYPE"]=>
NULL
["USER_TYPE_SETTINGS"]=>
NULL
["HINT"]=>
string(0) ""
["PROPERTY_VALUE_ID"]=>
array(3) {
[0]=>
string(4) "7497"
[1]=>
string(4) "7498"
[2]=>
string(4) "7499"
}
["VALUE"]=>
array(3) {
[0]=>
string(4) "3364"
[1]=>
string(4) "3365"
[2]=>
string(4) "3366"
}
["DESCRIPTION"]=>
array(3) {
[0]=>
NULL
[1]=>
NULL
[2]=>
NULL
}
["VALUE_ENUM"]=>
NULL
["VALUE_XML_ID"]=>
NULL
["VALUE_SORT"]=>
NULL
["~VALUE"]=>
array(3) {
[0]=>
string(4) "3364"
[1]=>
string(4) "3365"
[2]=>
string(4) "3366"
}
["~DESCRIPTION"]=>
array(3) {
[0]=>
NULL
[1]=>
NULL
[2]=>
NULL
}
["~NAME"]=>
string(14) "Галерея"
["~DEFAULT_VALUE"]=>
string(0) ""
}
}
["DISPLAY_PROPERTIES"]=>
array(1) {
["GALLERY"]=>
array(38) {
["ID"]=>
string(3) "548"
["TIMESTAMP_X"]=>
string(19) "2020-03-24 10:02:49"
["IBLOCK_ID"]=>
string(2) "14"
["NAME"]=>
string(14) "Галерея"
["ACTIVE"]=>
string(1) "Y"
["SORT"]=>
string(3) "500"
["CODE"]=>
string(7) "GALLERY"
["DEFAULT_VALUE"]=>
string(0) ""
["PROPERTY_TYPE"]=>
string(1) "F"
["ROW_COUNT"]=>
string(1) "1"
["COL_COUNT"]=>
string(2) "30"
["LIST_TYPE"]=>
string(1) "L"
["MULTIPLE"]=>
string(1) "Y"
["XML_ID"]=>
NULL
["FILE_TYPE"]=>
string(24) "jpg, gif, bmp, png, jpeg"
["MULTIPLE_CNT"]=>
string(1) "5"
["TMP_ID"]=>
NULL
["LINK_IBLOCK_ID"]=>
string(1) "0"
["WITH_DESCRIPTION"]=>
string(1) "N"
["SEARCHABLE"]=>
string(1) "N"
["FILTRABLE"]=>
string(1) "N"
["IS_REQUIRED"]=>
string(1) "N"
["VERSION"]=>
string(1) "1"
["USER_TYPE"]=>
NULL
["USER_TYPE_SETTINGS"]=>
NULL
["HINT"]=>
string(0) ""
["PROPERTY_VALUE_ID"]=>
array(3) {
[0]=>
string(4) "7497"
[1]=>
string(4) "7498"
[2]=>
string(4) "7499"
}
["VALUE"]=>
array(3) {
[0]=>
string(4) "3364"
[1]=>
string(4) "3365"
[2]=>
string(4) "3366"
}
["DESCRIPTION"]=>
array(3) {
[0]=>
NULL
[1]=>
NULL
[2]=>
NULL
}
["VALUE_ENUM"]=>
NULL
["VALUE_XML_ID"]=>
NULL
["VALUE_SORT"]=>
NULL
["~VALUE"]=>
array(3) {
[0]=>
string(4) "3364"
[1]=>
string(4) "3365"
[2]=>
string(4) "3366"
}
["~DESCRIPTION"]=>
array(3) {
[0]=>
NULL
[1]=>
NULL
[2]=>
NULL
}
["~NAME"]=>
string(14) "Галерея"
["~DEFAULT_VALUE"]=>
string(0) ""
["DISPLAY_VALUE"]=>
array(3) {
[0]=>
string(88) "Загрузить"
[1]=>
string(88) "Загрузить"
[2]=>
string(88) "Загрузить"
}
["FILE_VALUE"]=>
array(3) {
[0]=>
array(15) {
["ID"]=>
string(4) "3364"
["TIMESTAMP_X"]=>
object(Bitrix\Main\Type\DateTime)#183 (1) {
["value":protected]=>
object(DateTime)#187 (3) {
["date"]=>
string(26) "2021-04-28 08:24:13.000000"
["timezone_type"]=>
int(3)
["timezone"]=>
string(13) "Europe/Moscow"
}
}
["MODULE_ID"]=>
string(6) "iblock"
["HEIGHT"]=>
string(3) "960"
["WIDTH"]=>
string(3) "720"
["FILE_SIZE"]=>
string(6) "203010"
["CONTENT_TYPE"]=>
string(10) "image/jpeg"
["SUBDIR"]=>
string(10) "iblock/99e"
["FILE_NAME"]=>
string(36) "99e23af7c91fc31069231fb977cd9473.jpg"
["ORIGINAL_NAME"]=>
string(23) "IMG_20210426_123848.jpg"
["DESCRIPTION"]=>
string(0) ""
["HANDLER_ID"]=>
NULL
["EXTERNAL_ID"]=>
string(32) "6ad6635da717bd2c34819622a5e60368"
["~src"]=>
bool(false)
["SRC"]=>
string(55) "/upload/iblock/99e/99e23af7c91fc31069231fb977cd9473.jpg"
}
[1]=>
array(15) {
["ID"]=>
string(4) "3365"
["TIMESTAMP_X"]=>
object(Bitrix\Main\Type\DateTime)#189 (1) {
["value":protected]=>
object(DateTime)#188 (3) {
["date"]=>
string(26) "2021-04-28 08:24:13.000000"
["timezone_type"]=>
int(3)
["timezone"]=>
string(13) "Europe/Moscow"
}
}
["MODULE_ID"]=>
string(6) "iblock"
["HEIGHT"]=>
string(3) "774"
["WIDTH"]=>
string(4) "1032"
["FILE_SIZE"]=>
string(5) "73551"
["CONTENT_TYPE"]=>
string(10) "image/jpeg"
["SUBDIR"]=>
string(10) "iblock/2a9"
["FILE_NAME"]=>
string(36) "2a95e5db6d7f1be40826eb5564bea6d1.jpg"
["ORIGINAL_NAME"]=>
string(23) "IMG-20210426-WA0008.jpg"
["DESCRIPTION"]=>
string(0) ""
["HANDLER_ID"]=>
NULL
["EXTERNAL_ID"]=>
string(32) "a556314684d4bf17afd651fb55be1493"
["~src"]=>
bool(false)
["SRC"]=>
string(55) "/upload/iblock/2a9/2a95e5db6d7f1be40826eb5564bea6d1.jpg"
}
[2]=>
array(15) {
["ID"]=>
string(4) "3366"
["TIMESTAMP_X"]=>
object(Bitrix\Main\Type\DateTime)#186 (1) {
["value":protected]=>
object(DateTime)#185 (3) {
["date"]=>
string(26) "2021-04-28 08:24:13.000000"
["timezone_type"]=>
int(3)
["timezone"]=>
string(13) "Europe/Moscow"
}
}
["MODULE_ID"]=>
string(6) "iblock"
["HEIGHT"]=>
string(3) "960"
["WIDTH"]=>
string(3) "720"
["FILE_SIZE"]=>
string(6) "208697"
["CONTENT_TYPE"]=>
string(10) "image/jpeg"
["SUBDIR"]=>
string(10) "iblock/5f9"
["FILE_NAME"]=>
string(36) "5f98c6e7d913ce0903f50c636b5ee6da.jpg"
["ORIGINAL_NAME"]=>
string(23) "IMG_20210426_123815.jpg"
["DESCRIPTION"]=>
string(0) ""
["HANDLER_ID"]=>
NULL
["EXTERNAL_ID"]=>
string(32) "82c7bfeb6dcc257a98cd8bbfa7077cd4"
["~src"]=>
bool(false)
["SRC"]=>
string(55) "/upload/iblock/5f9/5f98c6e7d913ce0903f50c636b5ee6da.jpg"
}
}
}
}
["IBLOCK"]=>
array(90) {
["ID"]=>
string(2) "14"
["~ID"]=>
string(2) "14"
["TIMESTAMP_X"]=>
string(19) "03.02.2021 16:10:45"
["~TIMESTAMP_X"]=>
string(19) "03.02.2021 16:10:45"
["IBLOCK_TYPE_ID"]=>
string(4) "news"
["~IBLOCK_TYPE_ID"]=>
string(4) "news"
["LID"]=>
string(2) "s1"
["~LID"]=>
string(2) "s1"
["CODE"]=>
string(22) "bitrix_edusite_news_s1"
["~CODE"]=>
string(22) "bitrix_edusite_news_s1"
["API_CODE"]=>
NULL
["~API_CODE"]=>
NULL
["NAME"]=>
string(19) "[s1] Новости"
["~NAME"]=>
string(19) "[s1] Новости"
["ACTIVE"]=>
string(1) "Y"
["~ACTIVE"]=>
string(1) "Y"
["SORT"]=>
string(3) "500"
["~SORT"]=>
string(3) "500"
["LIST_PAGE_URL"]=>
string(6) "/news/"
["~LIST_PAGE_URL"]=>
string(6) "/news/"
["DETAIL_PAGE_URL"]=>
string(20) "#SITE_DIR#news/#ID#/"
["~DETAIL_PAGE_URL"]=>
string(20) "#SITE_DIR#news/#ID#/"
["SECTION_PAGE_URL"]=>
string(15) "#SITE_DIR#news/"
["~SECTION_PAGE_URL"]=>
string(15) "#SITE_DIR#news/"
["CANONICAL_PAGE_URL"]=>
string(0) ""
["~CANONICAL_PAGE_URL"]=>
string(0) ""
["PICTURE"]=>
NULL
["~PICTURE"]=>
NULL
["DESCRIPTION"]=>
string(0) ""
["~DESCRIPTION"]=>
string(0) ""
["DESCRIPTION_TYPE"]=>
string(4) "text"
["~DESCRIPTION_TYPE"]=>
string(4) "text"
["RSS_TTL"]=>
string(2) "24"
["~RSS_TTL"]=>
string(2) "24"
["RSS_ACTIVE"]=>
string(1) "Y"
["~RSS_ACTIVE"]=>
string(1) "Y"
["RSS_FILE_ACTIVE"]=>
string(1) "N"
["~RSS_FILE_ACTIVE"]=>
string(1) "N"
["RSS_FILE_LIMIT"]=>
NULL
["~RSS_FILE_LIMIT"]=>
NULL
["RSS_FILE_DAYS"]=>
NULL
["~RSS_FILE_DAYS"]=>
NULL
["RSS_YANDEX_ACTIVE"]=>
string(1) "N"
["~RSS_YANDEX_ACTIVE"]=>
string(1) "N"
["XML_ID"]=>
string(22) "bitrix_edusite_news_s1"
["~XML_ID"]=>
string(22) "bitrix_edusite_news_s1"
["TMP_ID"]=>
string(32) "37eb6af3f8a8da5080a02837476154e5"
["~TMP_ID"]=>
string(32) "37eb6af3f8a8da5080a02837476154e5"
["INDEX_ELEMENT"]=>
string(1) "Y"
["~INDEX_ELEMENT"]=>
string(1) "Y"
["INDEX_SECTION"]=>
string(1) "Y"
["~INDEX_SECTION"]=>
string(1) "Y"
["WORKFLOW"]=>
string(1) "N"
["~WORKFLOW"]=>
string(1) "N"
["BIZPROC"]=>
string(1) "N"
["~BIZPROC"]=>
string(1) "N"
["SECTION_CHOOSER"]=>
string(1) "L"
["~SECTION_CHOOSER"]=>
string(1) "L"
["LIST_MODE"]=>
string(0) ""
["~LIST_MODE"]=>
string(0) ""
["RIGHTS_MODE"]=>
string(1) "S"
["~RIGHTS_MODE"]=>
string(1) "S"
["SECTION_PROPERTY"]=>
string(1) "N"
["~SECTION_PROPERTY"]=>
string(1) "N"
["PROPERTY_INDEX"]=>
string(1) "N"
["~PROPERTY_INDEX"]=>
string(1) "N"
["VERSION"]=>
string(1) "1"
["~VERSION"]=>
string(1) "1"
["LAST_CONV_ELEMENT"]=>
string(1) "0"
["~LAST_CONV_ELEMENT"]=>
string(1) "0"
["SOCNET_GROUP_ID"]=>
NULL
["~SOCNET_GROUP_ID"]=>
NULL
["EDIT_FILE_BEFORE"]=>
string(0) ""
["~EDIT_FILE_BEFORE"]=>
string(0) ""
["EDIT_FILE_AFTER"]=>
string(0) ""
["~EDIT_FILE_AFTER"]=>
string(0) ""
["SECTIONS_NAME"]=>
string(14) "Разделы"
["~SECTIONS_NAME"]=>
string(14) "Разделы"
["SECTION_NAME"]=>
string(12) "Раздел"
["~SECTION_NAME"]=>
string(12) "Раздел"
["ELEMENTS_NAME"]=>
string(14) "Новости"
["~ELEMENTS_NAME"]=>
string(14) "Новости"
["ELEMENT_NAME"]=>
string(14) "Новость"
["~ELEMENT_NAME"]=>
string(14) "Новость"
["EXTERNAL_ID"]=>
string(22) "bitrix_edusite_news_s1"
["~EXTERNAL_ID"]=>
string(22) "bitrix_edusite_news_s1"
["LANG_DIR"]=>
string(1) "/"
["~LANG_DIR"]=>
string(1) "/"
["SERVER_NAME"]=>
string(7) "vmk1.ru"
["~SERVER_NAME"]=>
string(7) "vmk1.ru"
}
["SECTION"]=>
array(1) {
["PATH"]=>
array(0) {
}
}
["SECTION_URL"]=>
string(0) ""
["META_TAGS"]=>
array(3) {
["BROWSER_TITLE"]=>
string(0) ""
["KEYWORDS"]=>
string(0) ""
["DESCRIPTION"]=>
string(0) ""
}
["GALLERY"]=>
array(3) {
[0]=>
array(2) {
["S"]=>
string(78) "/upload/resize_cache/iblock/99e/250_150_2/99e23af7c91fc31069231fb977cd9473.jpg"
["L"]=>
string(79) "/upload/resize_cache/iblock/99e/1280_720_1/99e23af7c91fc31069231fb977cd9473.jpg"
}
[1]=>
array(2) {
["S"]=>
string(78) "/upload/resize_cache/iblock/2a9/250_150_2/2a95e5db6d7f1be40826eb5564bea6d1.jpg"
["L"]=>
string(79) "/upload/resize_cache/iblock/2a9/1280_720_1/2a95e5db6d7f1be40826eb5564bea6d1.jpg"
}
[2]=>
array(2) {
["S"]=>
string(78) "/upload/resize_cache/iblock/5f9/250_150_2/5f98c6e7d913ce0903f50c636b5ee6da.jpg"
["L"]=>
string(79) "/upload/resize_cache/iblock/5f9/1280_720_1/5f98c6e7d913ce0903f50c636b5ee6da.jpg"
}
}
}
Operator Gene — обзор
Введение катетера
Введение катетера зависит от оператора, места введения и техники введения. Оператор должен иметь хороший опыт или находиться под наблюдением опытного оператора. Как правило, туннельные катетеры с манжетами вводятся в операционных или чистых хирургических помещениях под рентгеноскопией — оператор в халате, перчатках и маске. Используются полные хирургические простыни, пациент замаскирован и получает комбинацию успокаивающего и обезболивающего.Катетеры без туннелирования обычно вводятся у постели больного или в отделении диализа с соблюдением всех барьерных мер предосторожности, состоящих из маски, стерильных перчаток, халата и большой простыни. Кожу можно продезинфицировать хлоргексидином, повидон-йодом или спиртом. Спирт дезинфицирует мгновенно, тогда как повидон-йод следует дать высохнуть в течение 2–3 минут для максимального антибактериального эффекта. Предпочтительным дезинфицирующим средством для кожи, рекомендованным Центрами по контролю и профилактике заболеваний (CDC), является хлоргексидин.
Ультрасонографическое руководство (США) при венозной пункции считается стандартом лечения, и все лица, вводящие ЦВК, должны быть обучены подходу, применяемому в США. УЗИ позволяет обученному оператору исследовать вену на предмет анатомических аномалий и непосредственно визуализировать венозную пункцию. Было показано, что УЗИ минимизирует осложнения при установке как во внутренней яремной, так и в бедренной области и приводит к уменьшению немедленной дисфункции катетера. Используя ультразвуковой контроль, неопытные операторы могут увеличить свой процент успеха до 95%.Рекомендации NKF-K / DOQI (Инициатива по качеству исходов заболеваний почек) поддерживают эту практику.
Предпочтительным местом размещения как туннельных, так и нетуннелированных катетеров является правая внутренняя яремная вена. Катетеры, помещенные в левую внутреннюю яремную вену, обеспечивают значительно меньший кровоток, чем правосторонние катетеры, и почти в четыре раза чаще требуют удаления в случае неисправности. Катетеры, помещенные в левую внутреннюю яремную вену, проходят через несколько изгибов как в латеральной, так и в переднезадней плоскостях по сравнению с катетерами для правой внутренней яремной вены, что приводит к потере плавного ламеллярного кровотока (рис.3.1 и 3.2). По возможности следует избегать размещения катетера в подключичной вене. Хотя исследования показали снижение частоты инфицирования при использовании подключичных катетеров, эти катетеры были связаны с увеличением стеноза центральной вены (что может поставить под угрозу создание постоянного доступа в ипсилатеральной руке в будущем). В проспективном исследовании, в котором пациенты прошли обычную венографию после удаления их первого подключичного катетера, у 52% пациентов был тромбоз / стеноз подключичной вены, и только половина из них реканализировалась через 3 месяца.Кроме того, хорошо известна частота субклинического стеноза подключичной вены у пациентов с устройствами контроля сердечного ритма.
На практике тромбоз / стеноз подключичной вены часто носит субклинический характер до тех пор, пока в ипсилатеральной руке не будет установлен артериовенозный доступ, что приводит к усилению венозного кровотока и проявляется явными клиническими признаками, такими как сильная опухоль руки. Лечение стеноза с помощью ангиопластики или стента сложно и требует повторных процедур для сохранения проходимости.Часто стеноз требует перевязки постоянного доступа и делает руку непригодной для создания постоянного доступа в будущем. Тромбоз / стеноз внутренней яремной вены встречается реже, чем подключичной вены (примерно 6–10%, как сообщается в литературе), и, как правило, не препятствует созданию постоянного артериовенозного доступа в будущем, если он не распространяется на верхнюю полую вену.
Катетеры без туннелирования имеют жесткий конический наконечник, что позволяет легко продвигать катетер по проволочному проводнику в вену.Напротив, туннельный катетер требует отслаивающейся оболочки из жестких стилетов для продвижения катетера по проволоке.
Нетуннелированные катетеры, помещенные в подключичную или внутреннюю яремную вену, перед началом диализа следует проверить с помощью рентгенографии грудной клетки или рентгеноскопии. Кончик нетуннелированного катетера должен находиться в верхней полой вене. Нетуннелированные катетеры обычно помещаются в бедренную вену у прикованных к постели пациентов, но уровень инфицирования выше, чем в любом из участков шеи.Наконечник катетера бедренной вены должен быть помещен в общую подвздошную вену и предпочтительно в нижнюю полую вену. Оценка дисфункционального катетера, помещенного в бедренную вену, должна включать рентгенографию брюшной полости, чтобы подтвердить, что расположение кончика по крайней мере выше края таза для общей подвздошной вены или на уровне L2 – L3 поясничных позвонков для размещения нижней полой вены.
Туннельные катетеры с манжетами могут быть помещены в бедренную вену, и в крайнем случае катетер может быть введен транслюмбальным и чреспеченочным путями непосредственно в нижнюю полую вену.
Катетеры можно перевязать либо стандартной, либо липкой сухой марлей, либо воздухопроницаемой прозрачной повязкой. Пациенты и лица, осуществляющие уход, могут почувствовать, что липкая повязка лучше закрепляет катетер или лучше защищает место выхода от загрязнения. У CDC нет определенных рекомендаций по перевязке катетера или использованию антисептиков или мазей с антибиотиками в месте выхода. Ключевой мерой предосторожности является сохранение повязки сухой и чистой, смена ее не реже одного раза в неделю и использование маски как пациентом, так и лицом, осуществляющим уход, при работе с катетером.
Многие осложнения были связаны с введением катетера для гемодиализа. Осложнения часто наблюдаются, когда оператор неопытен и венозная пункция выполняется вслепую, а не под контролем УЗИ. Средняя частота и диапазон осложнений в литературе приведены в таблице 3.2.
Операторная последовательность изменяет экспрессию генов независимо от занятости транскрипционного фактора в бактериях
Cell Rep. Автор рукописи; доступно в PMC 2013 3 апреля.
Опубликован в окончательной редакции как:
PMCID: PMC3616187
NIHMSID: NIHMS386941
, 1, 6, 9 , 3, 7, 9 , 2, 9 , 4, 8 , 4, * , 5, * и 2, *
Эрнан Г.Гарсиа
1 Физический факультет Калифорнийского технологического института, Пасадена, Калифорния
, США
6 Физический факультет Принстонского университета, Принстон, Нью-Джерси 08540, США
Альваро Санчес
3 Аспирантура Магистр биофизики и структурной биологии, Университет Брандейса, Уолтем, Массачусетс 02453, США
7 Физический факультет Массачусетского технологического института, Кембридж, Массачусетс 02139, США
Джеймс К.Boedicker
2 Департамент прикладной физики Калифорнийского технологического института, Пасадена, Калифорния
, США
Мелиса Осборн
4 Департамент биохимии, Брандейский университет, Уолтем, Массачусетс 02453, США
8 Гарвард Медицинский факультет и детская больница, Бостон, Массачусетс, США
Джефф Геллес
4 Департамент биохимии, Университет Брандейса, Уолтем, Массачусетс 02453, США
Джейн Кондев
5 Физический факультет University, Waltham, MA 02453, США
Роб Филлипс
2 Департамент прикладной физики Калифорнийского технологического института, Пасадена, Калифорния
, США
1 Физический факультет Калифорнийского технологического института, Пасадена, Калифорния
, США
2 Департамент прикладной физики Калифорнийского технологического института, Пасадена, Калифорния
, США
900 04 3 Аспирантура по биофизике и структурной биологии, Университет Брандейса, Уолтем, Массачусетс 02453, США
4 Департамент биохимии, Университет Брандейса, Уолтем, Массачусетс, США 02453, США
5 Физический факультет Университета Брандейса , Уолтем, Массачусетс 02453, США
6 Физический факультет Принстонского университета, Принстон, Нью-Джерси 08540, США
7 Физический факультет Массачусетского технологического института, Кембридж, Массачусетс 02139, США
8 Медицинская школа Гарвардского университета и детская больница, Бостон, Массачусетс 02115, США
9 Эти авторы внесли равный вклад в эту работу
Окончательная отредактированная версия этой статьи издателем доступна бесплатно в Cell Rep. См. Другие статьи в PMC, в которых цитируются опубликованные статья.
КРАТКОЕ ОПИСАНИЕ
Канонический количественный взгляд на регуляцию транскрипции утверждает, что единственная роль последовательности оператора — установить вероятность связывания фактора транскрипции, при этом занятость оператора определяет уровень экспрессии гена. В этой работе мы проверяем эту идею, охарактеризовав репрессию in vivo и связывание РНК-полимеразы in vitro в экспериментах, в которых операторы различных последовательностей были помещены выше или ниже промотора в Escherichia coli .Удивительно, но мы обнаружили, что операторы с более слабым сродством связывания могут давать более высокие уровни репрессии, чем более сильные операторы. Репрессор, связанный с вышестоящими операторами, модулирует ускользание от промотора, и величина этой модуляции не коррелирует со сродством связывания репрессора с оператором. Это предполагает, что операторные последовательности могут модулировать транскрипцию, изменяя природу взаимодействия связанного фактора транскрипции с транскрипционным аппаратом, что подразумевает новый уровень зависимости от последовательностей, с которым необходимо столкнуться при количественном понимании экспрессии генов.
ВВЕДЕНИЕ
Клетки контролируют, сколько, когда и где экспрессировать ген в ответ на изменения в их внутриклеточной и внеклеточной среде. Для осуществления этого контроля на каждом этапе пути от ДНК к активному белку используются различные механизмы (Alberts, 2008). Важный механизм регуляции генов у бактерий действует через факторы транскрипции, которые связываются со специфическими участками в промоторной области, последовательности ДНК непосредственно перед генами, где связывается РНК-полимераза.В результате взаимодействий или стерического вмешательства между факторами транскрипции, связанными с этими сайтами, и РНК-полимеразой происходит активация или репрессия транскрипции (Bintu et al., 2005b; Ptashne and Gann, 2002). Действительно, важной деятельностью современной науки о геноме является поиск сайтов связывания факторов транскрипции и определение правил, по которым архитектура промотора, т.е. положение и последовательность этих сайтов связывания, определяет уровень экспрессии гена (Buchler et al., 2003; Сигал и Видом, 2009).
Часто предполагается, что роль операторов просто состоит в том, чтобы действовать как стыковочные сайты для факторов транскрипции, рекрутируя их в промоторную область (Meijsing et al., 2009). С этой точки зрения, которую мы здесь называем «гипотезой занятости», последовательность оператора просто определяет его аффинность связывания с его целевым фактором транскрипции. Эта аффинность связывания вместе с концентрацией активных факторов транскрипции и взаимодействиями с другими ДНК-связывающими белками определяет занятость оператора, который, в свою очередь, как полагают, влияет на уровень регуляции транскрипции, осуществляемой фактором транскрипции (Alberts, 2008; Бинту и др., 2005b; Buchler et al., 2003; Дэвидсон, 2006). Например, мы рассматриваем промоторы, представляющие сайты связывания с различным сродством к репрессору. Учитывая это сродство связывания, внутриклеточное количество активных репрессоров будет определять вероятность обнаружения репрессора, связанного с каждым из операторов. В результате форма функции ввода-вывода, то есть уровень экспрессии выходного гена как функция входной концентрации репрессоров, будет достигать одного и того же уровня репрессии при разных концентрациях репрессоров, которые определяются связыванием родство операторов.Ожидается, что промотор, который содержит сильный оператор, сайт в ДНК, который прочно связывает фактор транскрипции, потребует более низкой внутриклеточной концентрации фактора транскрипции для достижения того же уровня репрессии (или активации), что и промотор, который имеет более слабый оператор (Bintu et al., 2005a, 2005b; Buchler et al., 2003; Vilar, Leibler, 2003). Количественно это можно выразить, сказав, что уровень транскрипции определяется вероятностями связывания этих факторов транскрипции с ДНК, как показано на.В результате, ключевое предсказание гипотезы занятости состоит в том, что при построении графика уровня экспрессии генов как функции занятости оператора все кривые, соответствующие разным операторам, независимо от их сродства, будут свертываться на основную кривую, как показано на.
Гипотеза занятости для действия факторов транскрипции и ее предсказания для регуляции гена
(A) Сайты связывания с разной аффинностью приводят к разной занятости в зависимости от количества репрессоров с более слабыми операторами, требующими большего количества репрессоров для достижения того же заполняемость.Формы кривых занятости и экспрессии генов в зависимости от количества репрессоров зависят от аффинности связывания оператора. Однако все эти кривые сворачиваются в единую универсальную кривую, когда уровень экспрессии генов отображается как функция занятости оператора. Обратите внимание, что использование репрессии для обозначения этой точки несущественно, и что то же самое можно сделать, используя активацию экспрессии генов.
(B) Альтернативная модуляция регуляторной архитектуры может проистекать из перемещения сайта связывания относительно промотора при сохранении константы сродства связывания оператора.В этом случае вероятность нахождения репрессора, связанного с оператором (занятость оператора), предположительно должна быть одинаковой для обеих конструкций. Расположение оператора, однако, как ожидается, будет модулировать характер взаимодействия между репрессором и транскрипционным аппаратом, приводя к различным функциям ввода-вывода для каждой регуляторной архитектуры.
Эффект модуляции аффинности оператора, поскольку контекст окружающей последовательности поддерживается постоянным, не следует путать с эффектом перемещения данного оператора относительно промотора при сохранении его аффинности константой, что схематично показано на рис.Поскольку аффинность поддерживается постоянной, в принципе можно ожидать, что вероятность обнаружения фактора транскрипции, связанного с оператором, в каждой из приведенных в качестве примеров конструкций будет такой же, как функция концентрации фактора транскрипции. Однако мы ожидаем, что относительное расположение оператора и промотора будет модулировать характер взаимодействия между транскрипционным фактором и транскрипционным аппаратом. В результате форма функции ввода-вывода каждой регуляторной архитектуры в принципе будет отличаться.
С точки зрения регуляции транскрипции, описанной выше, следует, что как только определяется занятость сайтов связывания факторами транскрипции в регуляторной области и известно влияние связанного фактора транскрипции на механизм транскрипции, результирующий уровень гена экспрессию можно рассчитать (Bintu et al., 2005b; Buchler et al., 2003; Segal et al., 2008; Vilar and Leibler, 2003). Этот взгляд на регуляцию транскрипции был поставлен под сомнение недавними результатами в эукариотических клетках, которые продемонстрировали, что сродство факторов транскрипции к различным кофакторам может модулироваться последовательностью сайта связывания фактора транскрипции (Lefstin and Yamamoto, 1998; Meijsing et al., 2009). Это говорит о том, что для полного понимания функции регуляторной области, влияние операторов на характер взаимодействия между факторами транскрипции и транскрипционным аппаратом, возможно, необходимо учитывать в дополнение к определению их положения в геноме и их сродства к факторы транскрипции.
Несмотря на эти недавние данные, многие количественные исследования как в бактериальном, так и в эукариотическом контексте явно или неявно используют гипотезу занятости для описания действия факторов транскрипции на уровне экспрессии генов (Ackers et al., 1982; Amit et al., 2011; Дэвидсон, 2006; Гарсия и Филлипс, 2011 г .; Герц и др., 2009; Пташне и Ганн, 2002; Сегал и др., 2008; Зинзен и др., 2009). Действительно, каждый раз, когда скорость продукции белка записывается в терминах функций Хилла, например, эта гипотеза занятости высказывалась неявно (Cağatay et al., 2009; Elowitz and Leibler, 2000; Fowlkes et al., 2008; Gardner et al., 2000; Klumpp et al., 2009; Kuhlman et al., 2007; Novák, Tyson, 2008; Tsai et al., 2008). В результате такие количественные описания регуляции транскрипции, по крайней мере, потенциально неполны и не соответствуют нашим текущим качественным знаниям о нюансах роли операторной последовательности, помимо определения сродства связывания.
В оставшейся части исследования мы демонстрируем форму модуляции в регуляции транскрипции, которая противоречит традиционной точке зрения занятости оператора, предполагая, что каноническая картина является неполной. Мы делаем это, применяя подход синтетической биологии, в котором мы намеренно настраиваем положение оператора, силу оператора и количество копий фактора транскрипции, чтобы систематически пересекать пространство параметров простой репрессионной архитектуры (т. Е. Случай, когда репрессор регулирует промотор благодаря наличию одного сайта связывания поблизости) репрессором Lac.Этот репрессор является одним из наиболее изученных факторов транскрипции (Müller-Hill, 1996). Посредством систематических измерений экспрессии генов in vivo, экспериментов с одиночными молекулами in vitro и теоретического моделирования мы показали, что, когда репрессор связывается выше промотора, выбор последовательности его сайта связывания оператора влияет на скорость синтеза мРНК, но что степень репрессий не учитывает ранжирование силы различных операторов, как это предсказывается моделью регулирования, основанной на занятости ().В результате мы расширяем количественный взгляд на роль операторной последовательности в контексте парадигматического взаимодействия репрессора Лака с оператором. В этом контексте последовательность оператора действует не только для определения занятости ДНК-связывающих белков, но также влияет на характер взаимодействий между факторами транскрипции и аппаратом транскрипции.
РЕЗУЛЬТАТЫ
Положение оператора ведет к разному репрессивному поведению
В Escherichia coli полногеномные исследования привели к созданию атласа сайтов связывания как для репрессоров, так и для активаторов, который дает картину разнообразия расположения сайтов связывания даже в случай простых репрессий.Например, мы показываем гистограмму положений сайтов связывания репрессоров, которые регулируют промоторы посредством простой репрессии в E. coli (Gama-Castro et al., 2008; Madan Babu and Teichmann, 2003). Как видно из этой гистограммы, простой мотив репрессии может действовать в широком диапазоне положений относительно сайта старта полимеразы.
Положение оператора приводит к разному репрессивному поведению выше и ниже промотора
(A) Гистограмма положений связывания фактора транскрипции по отношению к сайту начала транскрипции регулируемого промотора (Gama-Castro et al., 2008). Для справки: след ДНКазы РНК-полимеразы в открытом комплексе наложен голубым цветом (Straney and Crothers, 1987).
(B) Схема параметров, которые могут быть настроены in vivo, чтобы вызвать различные уровни экспрессии генов в рамках простой архитектуры репрессии.
(C) Подавление как функция положения оператора для последовательности операторов O1 и Oid.
(D) В отличие от случая подавления для оператора, расположенного на +11, функция подавления ввода-вывода на -50 показывает насыщение.Линии соответствуют данным +11 для уравнения S6 и данных -50 для уравнения S7. Положения определяются как расстояние между центром оператора и сайтом начала транскрипции lac UV5. Планки погрешностей — это стандартное отклонение за несколько повторов.
См. Также рисунки S1 и S2.
Чтобы исследовать эффекты положения оператора lac относительно сайта связывания полимеразы, мы провели систематические измерения экспрессии генов для различных операторов в зависимости от их положения относительно сайта начала транскрипции с разрешением одной пары оснований.Примеры параметров, изменяемых в библиотеке конструкций, используемых для анализа влияния позиционирования оператора на репрессию, показаны схематически, тогда как более подробная версия, включающая последовательности, показана на рисунках S1A – S1C. Мы использовали промотор lac UV5, который является мутантом промотора lac , который не требует активации CRP (Müller-Hill, 1996). Этот промотор контролирует экспрессию гена YFP или lacZ , который мы используем для количественной оценки уровня экспрессии гена.Мы измеряем регуляторный эффект репрессора Lac как репрессию, которая определяется как
Репрессия = Экспрессия (R = 0) Экспрессия (R 0),
(Уравнение 1)
, где R — внутриклеточное количество репрессоров. Когда оператор перемещается вниз по течению от сайта инициации транскрипции, уровень репрессии относительно не зависит от положения, пока центр оператора не достигнет +16, как показано на. В этих нижних положениях репрессор Lac может действовать по тому же механизму, что и в +11, где он блокирует образование открытого комплекса или более раннюю стадию инициации (Sanchez et al., 2011; Schlax et al., 1995). Однако также возможно, что по мере того, как репрессор перемещается из своего положения дикого типа, репрессия может осуществляться с помощью различных механизмов, как уже было показано для множества факторов транскрипции (Hochschild and Dove, 1998; Pavco and Steege, 1990, 1991; Rojo, 1999), возможно влияя на любую из различных стадий инициации или удлинения транскрипции, как схематически показано на фигурах S2A и S2B (Elledge and Davis, 1989; Lopez et al., 1998).
Напротив, когда оператора перемещают в положения выше по ходу от места инициации, уровень репрессии сильно зависит от местоположения оператора, и вариация репрессии является значительной, с как минимум 15-кратным эффектом между пики и впадины и впадины, соответствующие отсутствию репрессии ().Интересно, что профиль репрессии показывает два пика с разделением между ними ~ 10-11 п.н., что удивительно близко к периоду спирали двухцепочечной спирали ДНК (Amit et al., 2011; Becker et al., 2005; Lee and Schleif, 1989; Müller et al., 1996). Мы находим максимальный уровень репрессии, когда оператор центрируется на -50 парах оснований выше сайта инициации, с другим меньшим пиком на -61. Наши результаты качественно согласуются с предыдущими исследованиями влияния положения оператора lac на репрессию (Besse et al., 1986; Бонд и др., 2010; Элледж и Дэвис, 1989). Для подробного сравнения предыдущих результатов с нашей работой, пожалуйста, обратитесь к расширенным экспериментальным процедурам и рисункам S1D и S1E.
Чтобы лучше понять, как расположение оператора влияет на функцию ввода-вывода, мы измерили репрессию как функцию внутриклеточного числа репрессоров почти на два порядка величины количества репрессоров (Garcia and Phillips, 2011) для двух выбранных местоположения, одно ниже по течению в +11, положение O1 дикого типа в промоторе lac , и одно в -50, где находится пик максимальной вышележащей репрессии.Как показано на, два местоположения операторов различаются как качественно, так и количественно по характеру их функции ввода-вывода. Для местоположения +11 фактор репрессии линейно растет с внутриклеточным числом репрессоров. Такое поведение ожидается для механизма репрессии, основанного на блокировании образования открытого комплекса или более ранней стадии инициации, как обсуждали Garcia и Phillips (2011); Sanchez et al. (2011); Вилар и Лейблер (2003) и показаны в уравнении S6. Подробное описание этой модели в контексте простой репрессии для описанных выше конструкций можно найти в Extended Experimental Procedure, Figure S3A, and Garcia and Phillips (2011).
Напротив, для оператора при -50 мы обнаружили, что фактор репрессии растет с увеличением числа копий репрессора только до тех пор, пока не достигнет насыщения. Этот результат не может быть объяснен конкуренцией между репрессором Lac и РНК-полимеразой и предполагает, что РНК-полимераза может связываться с промотором и инициировать транскрипцию, даже когда репрессор Lac связан, хотя общая скорость транскрипции (т.е. единица времени) снижается присутствием репрессора до низкого, базального уровня, примерно в 40 раз ниже, чем нерегулируемый уровень.Таким образом, прямое предсказание этой гипотезы состоит в том, что репрессор Lac не полностью ингибирует образование стабильных комплексов РНК-полимераза-промотор при связывании при -50.
Однако важно отметить, что данные, полученные с помощью оператора на +11, также могут учитывать поведение насыщения. В расширенных экспериментальных процедурах и на рис. S2C мы подробно обсуждаем этот сценарий и делаем вывод, что, если бы это было так, это также сигнализировало бы о нарушении гипотезы занятости при подавлении этого хорошо изученного местоположения оператора.
Визуализация одной молекулы in vitro предполагает, что Lac-репрессор, расположенный на -50, и РНК-полимераза связаны одновременно
Чтобы проверить гипотезу, изложенную выше, и получить представление о механизме репрессии, когда оператор lac находится на -50 , мы провели эксперименты с одной молекулой, в которых можно непосредственно наблюдать занятость РНК-полимеразы на отдельных молекулах ДНК. Флуоресцентно меченую РНК-полимеразу и флуоресцентно меченную ДНК инкубировали вместе перед добавлением гепарина, который секвестрирует молекулы РНК-полимеразы, которые не образовали открытый комплекс.Наконец, реакционную смесь вводили в проточную камеру, получая устройство, показанное в (Sanchez et al., 2011). Мы использовали многоволновую флуоресцентную микроскопию полного внутреннего отражения одной молекулы (TIRF) для определения доли молекул ДНК, привязанных к поверхности камеры, которые были заняты РНК-полимеразой. Был проведен аналогичный эксперимент, в котором репрессор Lac предварительно инкубировали с ДНК перед добавлением РНК-полимеразы.
Восходящая репрессия посредством образования тройного комплекса Lac-репрессор-РНК-полимераза
(A) Эксперименты с одной молекулой in vitro, в которых степень занятости РНК-полимеразы на промоторной ДНК количественно оценивается путем флуоресцентного мечения каждого молекулярного вида (Sanchez et al., 2011).
(B) Показаны типичные поля зрения, где измеряется занятость РНК-полимеразы на ДНК для конструкций с O1, расположенным в +11 и -50, преинкубированных с репрессором Lac и без него.
(C) Анализ нескольких изображений, таких как показанные на (B), подтверждает присутствие связанной с промотором РНК-полимеразы для конструкции -50 из-за небольшого изменения в занятости РНК-полимеразы, вызванного присутствием репрессора. Напротив, наблюдается значительное кратное изменение занятости промотора РНК-полимеразой для конструкции +11, что согласуется с моделью ингибирования открытого комплекса и предыдущей работой (Sanchez et al., 2011). Для каждого условия было подсчитано более 500 молекул. Планки погрешностей — это стандартное отклонение для двух повторов для каждого условия.
См. Также рисунок S2.
Типичные поля зрения для эксперимента, проведенного с конструкциями +11 и -50, показаны на. Мы видим, что репрессор Lac вызывает значительные изменения в занятости ДНК РНК-полимеразой, когда оператор находится в +11, указывая на то, что репрессор Lac исключает образование стабильных открытых комплексов РНК-полимераза-ДНК.Напротив, когда оператор находится при -50, есть небольшие изменения, что предполагает, что репрессор Lac не способен предотвратить образование стабильных открытых комплексов РНК-полимераза-ДНК, когда репрессор связан в этом месте. При +11 присутствие стабильно связанной полимеразы на ДНК не устраняется полностью репрессором из-за существования сайта связывания непромоторной полимеразы, и, предположительно, аналогичный эффект происходит с нашими конструкциями -50, как описано ниже (подробности см. В расширенных экспериментальных процедурах. и Sanchez et al., 2011).
Для каждой конструкции было отображено много таких полей зрения. Подсчитывая количество комплексов РНК-полимераза-ДНК, которые образуются в отсутствие и в присутствии репрессора Lac (и корректируя долю тех событий, которые соответствуют РНК-полимеразе, связанной с непромоторным участком), мы можем рассчитать кратность изменения промотора. занятость полимеразой, индуцированная репрессором. Результаты представлены в таблице и суммируют средние значения заселенности, полученные в разных повторностях эксперимента с разными препаратами всех реагентов.Мы снова видим, что Lac-репрессор, связанный с +11, в значительной степени ингибирует занятость РНК-полимеразы на промоторной ДНК. В этой конструкции репрессор снижает образование открытых комплексов РНК-полимераза-промотор до (4,0 ± 0,4)% от количества комплексов, образующихся в отсутствие репрессора Lac. Это снижение согласуется с недавними измерениями с тем же промотором (Sanchez et al., 2011), которые показали, что Lac-репрессор работает, ингибируя образование открытых комплексов на промоторе lac UV5, и указывает на то, что в условиях наших экспериментов in vitro , а для используемых нами концентраций репрессора (200 нМ) и РНК-полимеразы (80 нМ) оператор O1 почти насыщен репрессором (~ 96%).Напротив, Lac-репрессор, связанный при -50, лишь незначительно снижает образование открытых комплексов, до (72 ± 22)% от этого показателя в отсутствие репрессора.
Эти количественные результаты показывают, что на занятость РНК-полимеразы на промоторе лишь незначительно влияет репрессор, связанный при -50. Если Lac-репрессор при -50 снижает образование открытых комплексов in vitro <в 2 раза, как мы можем наблюдать 40-кратное снижение экспрессии генов in vivo? Поскольку наши результаты предполагают, что репрессор Lac, связанный при -50, позволяет стабильно формировать открытые комплексы с помощью РНК-полимеразы на промоторе, они подразумевают, что регуляция уровня экспрессии генов происходит за счет существенного влияния репрессора на этапы, происходящие после образования открытого комплекса в путь инициации транскрипции.
В свете этих результатов мы предполагаем, что при -50 репрессор непосредственно влияет на общую скорость ускользания промотора, а не только на занятость РНК-полимеразы на промоторе в виде открытого комплекса. В результате мы предлагаем термодинамическую модель для in vivo предшествующей простой репрессии Lac-репрессором, которая схематизируется и систематически тестируется в следующем разделе.
Общая термодинамическая модель простой репрессии для вышестоящего сайта связывания репрессора
(A) Термодинамическая модель, вдохновленная нашими результатами in vitro, допускает взаимодействие между репрессором Lac (показано красным) и РНК-полимеразой (показано синим) с энергия ε rp .Кроме того, он допускает различные скорости инициации транскрипции в отсутствие или в присутствии репрессора. P и R — это количество молекул РНК-полимеразы и Lac-репрессора внутри клетки соответственно, а Δε pd и Δε rd — их соответствующие энергии взаимодействия с их конкретными сайтами, измеренными относительно их неспецифические энергии связи. N NS — размер бактериального генома в парах оснований.β = ( k B T ) −1 , где k B — постоянная Больцмана, а T — абсолютная температура. Скорость выхода промотора различна в отсутствие ( r 1 ) и в присутствии ( r 2 ) репрессора Lac. Подробное описание этой модели см. В Расширенных экспериментальных процедурах.
(B) Простые энергетические диаграммы возможных механизмов регуляции транскрипции: (i) дестабилизация комплекса РНК-полимераза-промотор, (ii) стабилизация комплекса РНК-полимераза-промотор, препятствующая ускользанию от промотора, и (iii) модуляция скорость побега промоутера.
(C) Репрессия как функция внутриклеточного числа репрессоров для O1, расположенного на -50. Механизм, который учитывает исключительно стабилизирующие взаимодействия [механизм (ii)], не может соответствовать данным независимо от значения, принятого его единственным свободным параметром ξ (см. Уравнение 2). Сплошная красная линия наилучшим образом соответствует данным такого механизма, в то время как пунктирные и пунктирные линии соответствуют изменению этого параметра в два раза. С другой стороны, механизм, который просто учитывает модуляцию скорости ускользания промотора [механизм (iii)], также имеющий только один свободный параметр, может соответствовать данным.Подробности этих двух механизмов приведены в основном тексте и в расширенных экспериментальных процедурах. Планки погрешностей — это стандартное отклонение за несколько повторов.
См. Также рисунок S3.
Функция ввода-вывода простой репрессии из вышестоящих позиций включает в себя модуляцию скорости выхода промотора репрессором
Общая модель восходящей репрессии, предложенная на основе наших экспериментальных результатов и показанная на рисунке, охватывает три различных механизма регуляции: (i) прямое дестабилизирующее взаимодействие между РНК-полимеразой и репрессором Lac, которое снижает занятость полимеразы на промоторе, когда репрессор присутствует; энергия комплекса эффективно увеличивает количество энергии, необходимое РНК-полимеразе для продвижения вперед по пути транскрипции, и (iii) увеличение энергии активации для выхода промотора без какой-либо стабилизации РНК-полимеразы при связывании репрессора Lac к ДНК.В последнем случае репрессор Lac не влияет на занятость состояний, а влияет только на кинетику выхода РНК-полимеразы с промотора. Эти механизмы не исключают друг друга, но могут действовать вместе, чтобы осуществлять регулирование в зависимости от значений различных параметров модели. Диаграммы различных реакций, соответствующие каждому из этих механизмов, схематически показаны на. Далее мы исследуем эти три случая путем количественного сравнения теоретических прогнозов и данных выражения.
Начнем с рассмотрения механизма (i). Качественно этот механизм предсказывает взаимную дестабилизацию между Lac-репрессором и РНК-полимеразой, так что присутствие РНК-полимеразы на промоторе будет затронуто в присутствии репрессора. Однако наши результаты in vitro, показанные в, позволяют предположить, что на занятость промотора существенно не влияет. Мы заключаем, что этот эффект, если он присутствует, будет небольшой по величине. Поэтому мы больше не рассматриваем этот механизм в данной работе.Дальнейшее обсуждение этого вопроса можно найти в Расширенных экспериментальных процедурах.
Далее мы рассмотрим механизм (ii), который приводит к следующему выражению для репрессии как функции количества копий репрессора
Репрессия (ii) = 1 + 2RNNSe − βΔεrdξ1 + 2RNNSe − βΔεrd = 1 + (ξ − 1) 2RNNSe − βΔεrd1 + 2RNNSe − βΔεrd,
(Уравнение 2)
где ξ — это функция параметра взаимодействия ε rp , энергии связывания полимеразы с промотором и числа копий полимераз.Обратите внимание, что параметр ξ может определять только максимальный уровень выражения. Однако он не влияет на полуточку, число копий репрессора, при котором репрессия достигает половины своего максимального значения (эта полуточка аналогична константе диссоциации, см. Расширенные экспериментальные процедуры и рисунки S3B и S3C. для получения дополнительной информации).
Наконец, если мы возьмем механизм (iii), где нет стабилизирующего взаимодействия между репрессором и полимеразой, но есть изменение скорости выхода промотора, мы получим выражение
Репрессия (iii) = 1 + 2RNNSe − βΔεrd1 + r2r12RNNSe − βΔεrd = 1 + (1 − r2r1) 2RNNSe − βΔεrd1 + r2r12RNNSe − βΔεrd.
(Уравнение 3)
Этот механизм дает нам новый параметр для рассмотрения: отношение скорости ускользания РНК-полимеразы в присутствии репрессора к скорости в его отсутствие, r 2 / r 1 , как показано в . Однако, в отличие от ξ в механизме (ii), этот параметр устанавливает значение как полуточки репрессионной кривой (обратите внимание на присутствие r 2 / r 1 в знаменателе), так и максимального значения. уровень репрессии (см. Расширенные экспериментальные процедуры и рисунки S3B и S3C).
Продолжая использовать стратегию, мы проанализировали простую репрессию выше промотора, чтобы проверить предсказания различных регуляторных механизмов, представленных моделью, показанной в. Мы создали конструкции ДНК, содержащие все четыре lac операторов (Oid, O1, O2 и O3, в порядке от высокого к низкому сродству) при -50, и поместили их в штаммы, содержащие различное внутриклеточное количество репрессора Lac, охватывающее почти два порядка. величины (Гарсия и Филлипс, 2011).
показывает репрессию как функцию количества репрессора для O1, расположенного на -50. Как было показано ранее в, один из удивительных результатов при сравнении репрессии при -50 с репрессией при +11 состоит в том, что репрессия на +11 растет с количеством репрессоров, как того требует уравнение S6 (см. Рисунок S3A и Garcia and Phillips [2011] ), тогда как при -50 наблюдается насыщение репрессии. Это насыщение не согласуется с моделью, воплощенной в уравнении S6.
Учитывая наши предыдущие знания об энергиях связывания репрессора Lac in vivo с различными операторами (см. Расширенные экспериментальные процедуры и Гарсиа и Филлипс [2011]), формулы репрессии для механизмов (ii) и (iii), обсуждаемых выше, имеют только одну свободную каждый параметр: ξ для механизма (ii) и отношение r 2 / r 1 для механизма (iii).В мы показываем соответствие обоих механизмов нашим экспериментальным данным с O1, расположенным на -50, показанном на (для соображений по подгонке данных, пожалуйста, обратитесь к расширенным экспериментальным процедурам). Как показано различными красными линиями на этом рисунке, механизм (ii), показанный в уравнении 2, создает кривые неправильной формы и, таким образом, не может соответствовать данным независимо от выбора параметра ξ. С другой стороны, механизм (iii), который приводит к уравнению 3, может соответствовать данным, как показано зеленой линией на рис.
На основании приведенного выше анализа мы предполагаем, что основным способом регуляции репрессором является модуляция скорости ускользания промотора с помощью РНК-полимеразы.Это не исключает вклада стабилизирующего взаимодействия между репрессором и полимеразой. Фактически, комбинация обеих регуляторных стратегий также может соответствовать данным, как показано на Рисунке S3B. Однако регулирование скорости побега представляет собой минимальный механизм, достаточный для объяснения данных. Мы предположим, что этот механизм для дальнейшего изучения репрессии, когда оператор находится на -50.
Сила оператора недостаточна для объяснения уровня репрессии
Учитывая наши знания о модуляции скорости побега репрессором Lac, полученные из данных O1, мы прогнозируем формы функций ввода-вывода для оставшихся lac операторы в.Согласно гипотезе занятости модель, соответствующая этому механизму (механизм (iii), показанный в уравнении 3), предсказывает, что репрессия насыщается на одном и том же уровне независимо от выбора оператора, потому что разные операторные последовательности изменяют только сродство репрессора Lac к операторной ДНК. Однако выбор оператора определяет половину репрессии способом, который следует четкому порядку ранжирования, основанному на сродстве связывания репрессора различных рассматриваемых операторов.
Репрессия при -50 с помощью Lac Repressor в зависимости от количества копий репрессора и сродства к оператору не согласуется с гипотезой занятости
(A) Учитывая модуляцию скорости транскрипции, полученную при подборе данных O1, показанных в, и наших предыдущих знаниях Из энергий связывания in vivo мы прогнозируем форму функции ввода-вывода для конструкций, в которых используются различные операторы (линии).Измеренная репрессия (кружки) систематически не согласуется с предсказаниями модели.
(B) Допуская модуляцию скорости транскрипции ( r 2 / r 1 ) для каждого оператора, мы можем успешно сопоставить данные. Обратите внимание, что модуляция не имеет корреляции с силой оператора.
O1Flip — обратное дополнение к O1, а пунктирная зеленая линия соответствует подгонке полученных экспериментальных данных. Планки погрешностей — это стандартное отклонение за несколько повторов.
См. Также рисунки S4, S5 и S6.
В также приведены соответствующие экспериментальные данные. Из этого графика видно, что модель не может описывать данные. В частности, одновременно интригует и удивительно, что данные для разных операторов насыщаются на разных уровнях и что это насыщение не следует за порядком ранжирования аффинности связывания операторов in vivo и in vitro. Например, репрессор Lac связывается с Oid в ~ 20 раз сильнее, чем O2, с K d для Oid при ~ 170 пМ и K d для O2 при ~ 4 нМ.Тем не менее, эти два оператора имеют сравнимый уровень репрессии при большом количестве репрессоров ~ 900. С другой стороны, Oid также связан в ~ 5 раз сильнее, чем O1, при этом O1 имеет K d ~ 1 нМ. Тем не менее, O1 представляет более высокий уровень репрессии, чем Oid при том же внутриклеточном числе репрессоров, равном 900. Возможно, даже более интересно, если мы заменим сайт связывания O1 его обратным комплементом, который должен оставить неизменным его сродство связывания, мы увидим качественно поведение, отличное от поведения O1 дикого типа, что позволяет предположить, что одной аффинности связывания недостаточно для определения различных уровней насыщения.
Если мы откажемся от представления о том, что единственная роль операторной последовательности заключается в установке сродства связывания репрессора Lac с ДНК, и примем точку зрения, согласно которой он может модулировать скорость инициации транскрипции зависимым от последовательности способом (с другим выбором параметра r 2 / r 1 ) наша модель может учесть все экспериментальные данные. Например, выбор оператора может модулировать характер взаимодействия между репрессором и РНК-полимеразой.показывает, что, когда мы позволяем параметру r 2 / r 1 изменяться с последовательностью операторов, модель теперь учитывает экспериментальные данные. Таким образом, наблюдаемое различие в модуляции скорости инициации для разных конструкций противоречит интерпретации, согласно которой роль сайтов связывания заключается исключительно в определении вероятности обнаружения репрессора, связанного с ДНК, но согласуется с моделями, в которых последовательность оператора может изменить природу взаимодействия репрессор-полимераза таким образом, чтобы модулировать скорость ускользания полимеразы.
Альтернативная гипотеза состоит в том, что модификация операторной последовательности приводит к изменению нерегулируемого уровня экспрессии гена. В этом случае различия в наблюдаемых соотношениях r 2 / r 1 могут быть связаны исключительно с изменением r 1 для каждого оператора. На рисунке S4 мы показываем, что нет значительной корреляции между нерегулируемыми уровнями экспрессии и подобранными значениями r 2 / r 1 .Мы пришли к выводу, что наблюдаемый эффект операторных последовательностей не может быть объяснен изменением нерегулируемых уровней экспрессии.
Альтернативный способ исследовать влияние последовательности операторов на уровень подавления — повторное отображение данных для подавления в зависимости от занятости оператора. Как описано во введении, гипотеза занятости подразумевает, что все данные должны лежать на одной кривой, как показано на. На рисунке S5 и расширенных экспериментальных процедурах мы показываем, что, хотя данные для конструкций +11 коллапсируют, как и ожидалось, данные, соответствующие конструкциям -50, нет, что снова указывает на то, что занятость репрессора недостаточна для определения уровня репрессии.
Модель, используемая до сих пор, представляет упрощенный взгляд на инициацию транскрипции, которая объединяет как закрытые, так и открытые комплексы в один эффективный комплекс. Однако те же самые выводы без потери общности можно сделать, если рассматривать оба комплекса независимо (см. Расширенные экспериментальные процедуры и рисунок S6). Кроме того, используемая термодинамическая модель предполагает квазиравновесие между состояниями, ведущими к выходу промотора. Если мы рассмотрим полную кинетическую модель, в которой не делается никаких предположений о равновесии, мы, тем не менее, придем к тем же выводам (см. Расширенные экспериментальные процедуры): разные уровни репрессии, наблюдаемые для разных последовательностей операторов, помещенных в положение -50, не могут быть объяснены в контексте гипотезы занятости.
ОБСУЖДЕНИЕ
Гипотеза занятости утверждает, что роль операторной последовательности состоит в том, чтобы определять ее занятость целевым фактором транскрипции. Затем характер взаимодействия между связанным фактором транскрипции и аппаратом транскрипции определяется пространственным расположением сайтов связывания и контекстом последовательности ДНК, т. Е. Наличием сайтов связывания ДНК для других белков поблизости, конкретными механическими свойствами белков. окружающая ДНК и т. д.(Дэвидсон, 2006; Пташне, Ганн, 2002). Например, относительное расположение между сайтами связывания и механические свойства вмешивающейся ДНК могут иметь решающее влияние на регуляторные функции ввода-вывода генов (Aki et al., 1996; Amit et al., 2011; Belyaeva et al., 1998; Browning and Busby, 2004; Busby et al., 1994; Choy et al., 1995, 1997; Gaston et al., 1990; Hogan, Austin, 1987; Joung et al., 1994; Joung et al., 1993; Lilja et al., 2004; Mao et al., 1994; Ryu et al., 1998). Кроме того, природа промотора может влиять на то, как фактор транскрипции будет взаимодействовать с связанной с ним РНК-полимеразой (Monsalve et al., 1996, 1997). Большинство современных моделей действия различных известных взаимодействий между факторами транскрипции и транскрипционным аппаратом основаны на допущении применимости гипотезы занятости (Bintu et al., 2005b; Buchler et al., 2003; Segal and Widom, 2009). ; Вилар, Лейблер, 2003).
В нескольких недавних работах было высказано предположение, что эта каноническая картина регуляции транскрипции является неполной (см. Haugen et al., 2008 и Voss et al., 2011 для двух конкретных примеров).Более непосредственно связанная с этой работой, гипотеза занятости была предложена как недостаточная для описания регуляции MarA у бактерий (Martin et al., 2008; Wall et al., 2009), и примеры, когда гипотеза занятости не соответствовала действительности, были обнаружены в контекст регуляции кофакторов факторами транскрипции у эукариот, как мы описываем ниже (Meijsing et al., 2009; Scully et al., 2000).
В этом исследовании мы количественно расширили наше понимание парадигматического репрессора Lac и показали, что последовательность оператора, расположенного выше промотора, может диктовать различные регуляторные функции ввода-вывода гена, приводя к различным максимальным значениям репрессии, которые не могут быть объяснены занятость репрессора на ДНК.Мы использовали теоретические модели регуляции транскрипции, чтобы качественно и количественно обосновать эти выводы. Независимо от того, используются ли термодинамические модели или кинетическая модель, в которой не делается предположения о равновесии (см. Рисунок S6), выводы не зависят от конкретной теоретической основы, используемой для анализа экспериментальных результатов. В результате, явно нарушая гипотезу занятости, мы заключаем, что последовательности операторов lac кодируют больше, чем просто сродство связывания репрессора: они также могут определять природу «эффективного» взаимодействия между репрессором и РНК-полимеразой.Мы подчеркиваем слово «эффективный», чтобы прояснить, что наша модель не может определить, вызван ли эффект прямым контактом между репрессором и РНК-полимеразой, из-за того, что информация передается через ДНК каким-то «аллостерическим» способом или из-за какого-то другого, неизвестный механизм.
Каков механистический характер эффективного взаимодействия между репрессором Lac и РНК-полимеразой? Положение -50, в котором мы провели наиболее детальную характеристику вышестоящей репрессии, находится в пределах следа субъединицы С-концевого домена альфа-CTD (αCTD) РНК-полимеразы (Newlands et al., 1991). Это указывает на то, что αCTD может участвовать в механизме репрессии посредством прямого контакта с репрессором аналогично активаторам класса I (Busby and Ebright, 1999). Предсказание этой гипотезы прямого контакта состоит в том, что если мы вводим мутации или делеции в αCTD, репрессия должна быть отменена. Напротив, в аллостерической гипотезе такие мутации должны иметь небольшой эффект, потому что репрессия опосредуется связыванием с ДНК, а не контактами белок-белок.Предыдущие эксперименты Адхьи и его сотрудников пролили свет на эту проблему (Choy et al., 1995, 1997; Roy et al., 2004). Они обнаружили, что репрессор Lac (а также репрессор Gal), связанный с оператором в точке -60 (положение вторичного пика репрессии в), репрессирует транскрипцию промотора galP1 , и что делеция αCTD полностью снижает репрессию в точке -60. (Чой и др., 1995). Кроме того, мутации в αCTD также отменяют репрессию (Choy et al., 1997). Оба этих эксперимента подтверждают гипотезу о прямом контакте.Более того, было обнаружено, что мутант с единственной точечной мутацией в GalR способен связываться с оператором при -60, но не репрессировать транскрипцию (Roy et al., 2004). Стоит отметить, что все эти эксперименты были проведены для промотора, отличного от того, который мы здесь охарактеризовали. Однако их результаты подтверждают механизм, основанный на прямом контакте между репрессором и РНК-полимеразой.
Ни одна из различных механистических гипотез, обсуждаемых выше, не может объяснить, почему разные последовательности операторов определяют уровень подавления таким образом, который не коррелирует с занятостью оператора репрессором, что приводит к нарушению гипотезы занятости.Одно из возможных объяснений состоит в том, что эти различные регуляторные результаты являются результатом тонких различий в трехмерных структурах комплексов белок-ДНК или в динамике этих молекул. Эти различия могут привести к изменению взаимодействий с РНК-полимеразой или промоторной областью и привести к модуляции экспрессии генов. Фактически, различия в структуре наблюдались для связывающего домена репрессора Lac, связанного с его различными операторами, а также для структурных параметров промежуточной ДНК, таких как скручивание, скручивание и стэкинг пар оснований, но их корреляция с какими-либо фенотипическими эффектами неясна. (Kalodimos et al., 2002, 2004; Романука и др., 2009). Тогда также можно предположить, что информация о том, какой оператор присутствует, передается через саму ДНК. Однако, поскольку эти исследования разрешили только ДНК-связывающий домен, остается неясным, была ли изменена каким-либо существенным образом конформация оставшегося белка. Несмотря на неопределенность относительно детального молекулярного механизма, зависящего от последовательности, представленная здесь работа является дальнейшим шагом к более детальному пониманию молекулярных взаимодействий, осуществляемых факторами транскрипции.
Несколько исследований эукариотических клеток ранее показали, что ДНК может действовать как нечто большее, чем просто стыковочный сайт для факторов транскрипции; кроме того, он может действовать как аллостерический лиганд, который передает информацию о способе регуляции генов (Geserick et al., 2005; Ma et al., 2010). Эти исследования показали, что конкретная последовательность сайта связывания фактора транскрипции определяет сродство связанного фактора транскрипции к другому набору корепрессоров или коактиваторов. Эти изменения аффинности могут иметь глубокие физиологические эффекты, как предполагалось для фактора Pit-1, рецептора глюкокортикоидов и NF-κB (Lefstin and Yamamoto, 1998; Leung et al., 2004; Meijsing et al., 2009; Скалли и др., 2000).
Наше исследование демонстрирует, что модуляция активности фактора транскрипции последовательностью ДНК его сайта связывания может быть гораздо более общим явлением, происходящим, как показано здесь, у бактерий, а также у эукариот, несмотря на различия между механизмами транскрипции в этих двух доменах. жизни. Наше исследование было выполнено на E. coli , где регуляция транскрипции, как полагают, намного проще, чем у эукариот, и мы использовали промотор, который не включает никаких кофакторов.Эта простота позволила нам найти прямую механистическую связь между последовательностью ДНК оператора и результатом транскрипции. Эти результаты предполагают, что подобный эффект операторной последовательности на модуляцию ускользания промотора может возникать в других бактериальных факторах транскрипции, которые либо останавливают, либо усиливают транскрипцию на той же стадии, что недавно было предложено для активации с помощью MarA (Martin et al., 2008; Wall et al., 2009). Таким образом, промоторы, регулируемые MarA, могут быть хорошими кандидатными системами для дальнейшего исследования общности наших открытий в регуляции бактериальных генов.
Большая часть работ, посвященных изучению регуляторных областей генов, была основана на предположении о применимости гипотезы занятости (Ackers et al., 1982; Amit et al., 2011; Bintu et al., 2005a; Davidson, 2006). ; Gertz et al., 2009; Ptashne, Gann, 2002; Raveh-Sadka et al., 2012; Segal et al., 2008; Segal, Widom, 2009; Zinzen et al., 2009). Это исследование дает дополнительные доказательства существования дополнительного уровня сложности, который необходимо учитывать в регуляции транскрипции, обусловленной природой взаимодействия между факторами транскрипции и транскрипционным аппаратом, налагаемым последовательностью сайта связывания фактора транскрипции.Учитывая тот факт, что большое количество репрессоров действует на промоторы путем связывания с одним сайтом, расположенным выше промоторной области в E. coli (см. И Gama-Castro et al., 2008), возможно, что этот механизм репрессии может быть широко распространенным. Таким образом, знания списка операторов и их сильных сторон недостаточно для прогнозирования функции ввода-вывода промоутера. Детальный анализ конкретных репрессоров будет необходим, чтобы определить, насколько широко могут быть наблюдаемые здесь эффекты.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Плазмиды, штаммы и измерения in vivo
Конструирование всех плазмид и штаммов описано в расширенных экспериментальных процедурах. Короче говоря, мы поместили репортерный ген YFP или lacZ под контроль промотора lac UV5 и регуляцию одного из четырех операторов lac в различных положениях по отношению к сайту начала транскрипции. Различные конструкции, используемые в статье, схематически показаны на рисунках S1A – S1C.Эти конструкции были интегрированы в хромосому штаммов E. coli , несущих различное внутриклеточное количество репрессора Lac (Garcia and Phillips, 2011).
Измерения экспрессии генов проводили с использованием планшет-ридера, как описано в расширенных экспериментальных процедурах и (Garcia et al., 2011).
Эксперименты с одной молекулой
Эксперименты с одной молекулой проводили, как описано в расширенных экспериментальных процедурах и (Sanchez et al., 2011).Вкратце, флуоресцентно и биотин-меченную ДНК, содержащую промотор и сайт связывания репрессора, инкубировали в присутствии РНК-полимеразы, меченной вторым спектрально отличным флуорофором. Молекулы ДНК связывали с предметным стеклом, покрытым стрептавидином, и количественно определяли долю молекул ДНК, связанных с РНК-полимеразой. Для того чтобы оценить влияние репрессора на образование комплексов, связанных с РНК-полимеразой, ДНК предварительно инкубировали с репрессором перед добавлением РНК-полимеразы и снова визуализировали полученную реакцию.Как сообщалось ранее (Sanchez et al., 2011), не все молекулы ДНК, связанные с РНК-полимеразой, соответствуют стабильным открытым комплексам. Это было учтено в нашем анализе. Подробности, относящиеся к этому моменту, можно найти в Расширенных экспериментальных процедурах.
Благодарности
Мы благодарны Джону Видому, Тому Кульману, Джастину Кинни, Стефани Джонсон, Дэниелу Джонсу и Робу Брюстеру за полезные обсуждения. Мы посвящаем эту работу профессору Видому, который недавно неожиданно скончался.Мы хотели бы поблагодарить Ларри Фридмана за техническую помощь с экспериментами с одной молекулой и за полезные обсуждения. Мы благодарим Роберта Лэндика, Рэйчел Муни и Эбби Вангелофф за щедрые подарки очищенной SNAP-меченой ядерной РНК-полимеразы и σ 70 . Эта работа была поддержана грантом DP1 OD000217 (HGG, RP) Национального института здравоохранения и грантами R01 GM085286 и R01 GM085286-01S (HGG, JQB, RP), GM81648 и GM43369 (JG, AS, MLO), La Fondation Pierre Gilles де Женн (Р.P.) и награды Национального научного фонда DMR-0706458 (J.K.) и MRSEC-0820492 (J.K., J.G.).
Ссылки
- Ackers GK, Johnson AD, Shea MA. Количественная модель регуляции гена репрессором фага лямбда. Proc Natl Acad Sci USA. 1982; 79: 1129–1133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Aki T, Choy HE, Adhya S. Гистоноподобный белок HU как специфический регулятор транскрипции: роль кофактора в репрессии транскрипции gal репрессором GAL. Гены Клетки.1996; 1: 179–188. [PubMed] [Google Scholar]
- Альбертс Б. Молекулярная биология клетки. Пятое издание. Нью-Йорк: наука о гирляндах; 2008. [Google Scholar]
- Амит Р., Гарсия Х. Г., Филлипс Р., Фрейзер С. Е.. Создание усилителей с нуля: подход синтетической биологии. Клетка. 2011; 146: 105–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Becker NA, Kahn JD, Maher LJ., 3-я петля репрессии бактерий требует повышенной гибкости ДНК. J Mol Biol. 2005; 349: 716–730. [PubMed] [Google Scholar]
- Беляева Т.А., Родиус В.А., Вебстер К.Л., Басби С.Дж.Активация транскрипции на промоторах, несущих сайты тандемной ДНК для белка циклического рецептора AMP Escherichia coli : организация альфа-субъединиц РНК-полимеразы. J Mol Biol. 1998. 277: 789–804. [PubMed] [Google Scholar]
- Бессе М., фон Вилькен-Бергманн Б., Мюллер-Хилл Б. Синтетический оператор lac опосредует репрессию через репрессор lac при введении выше и ниже промотора lac. EMBO J. 1986; 5: 1377–1381. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bintu L, Buchler NE, Garcia HG, Gerland U, Hwa T., Kondev J, Kuhlman T., Phillips R.Регуляция транскрипции по номерам: приложения. Curr Opin Genet Dev. 2005a; 15: 125–135. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bintu L, Buchler NE, Garcia HG, Gerland U, Hwa T., Kondev J, Phillips R. Транскрипционная регуляция в цифрах: модели. Curr Opin Genet Dev. 2005b; 15: 116–124. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Бонд Л.М., Питерс Дж. П., Беккер Н. А., Кан Дж. Д., Махер Л. Дж., Репрессия 3-го гена с помощью минимальных петель lac in vivo. Nucleic Acids Res. 2010; 38: 8072–8082.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Browning DF, Busby SJ. Регуляция инициации бактериальной транскрипции. Nat Rev Microbiol. 2004; 2: 57–65. [PubMed] [Google Scholar]
- Buchler NE, Gerland U, Hwa T. О схемах комбинаторной логики транскрипции. Proc Natl Acad Sci USA. 2003; 100: 5136–5141. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Busby S, Ebright RH. Активация транскрипции белком-активатором катаболита (CAP) J Mol Biol. 1999; 293: 199–213.[PubMed] [Google Scholar]
- Басби С., Уэст Д., Лоус М., Вебстер С., Исихама А., Колб А. Активация транскрипции белком циклического рецептора AMP Escherichia coli. Рецепторы, связанные тандемом на промоторах, могут взаимодействовать синергетически. J Mol Biol. 1994; 241: 341–352. [PubMed] [Google Scholar]
- Cağatay T., Turcotte M, Elowitz MB, Garcia-Ojalvo J, Süel GM. Зависимый от архитектуры шум различает функционально аналогичные схемы дифференцирования. Клетка. 2009. 139: 512–522. [PubMed] [Google Scholar]
- Choy HE, Park SW, Aki T, Parrack P, Fujita N, Ishihama A, Adhya S.Репрессия и активация транскрипции репрессорами Gal и Lac: участие альфа-субъединицы РНК-полимеразы. EMBO J. 1995; 14: 4523–4529. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Choy HE, Hanger RR, Aki T., Mahoney M, Murakami K, Ishihama A, Adhya S. Репрессия и активация активности связанной с промотором РНК-полимеразы репрессором Gal. J Mol Biol. 1997. 272: 293–300. [PubMed] [Google Scholar]
- Дэвидсон Э. Регуляторный геном: регуляторные сети генов в развитии и эволюции.Берлингтон, Массачусетс; Сан-Диего, Калифорния: академический; 2006. [Google Scholar]
- Элледж С.Дж., Дэвис Р.В. Влияние положения и плотности на репрессию стационарными и мобильными ДНК-связывающими белками. Genes Dev. 1989; 3: 185–197. [PubMed] [Google Scholar]
- Эловиц М.Б., Лейблер С. Синтетическая осцилляторная сеть регуляторов транскрипции. Природа. 2000. 403: 335–338. [PubMed] [Google Scholar]
- Fowlkes CC, Hendriks CL, Keränen SV, Weber GH, Rübel O, Huang MY, Chatoor S, DePace AH, Simirenko L, Henriquez C, et al.Количественный пространственно-временной атлас экспрессии генов в бластодерме дрозофилы. Клетка. 2008. 133: 364–374. [PubMed] [Google Scholar]
- Гама-Кастро С., Хименес-Хасинто В., Перальта-Хиль М., Сантос-Завалета А., Пеньялоса-Спинола, М. И., Контрерас-Морейра Б., Сегура-Салазар Дж, Муньис-Раскадо Л., Мартинес -Flores I, Salgado H, et al. RegulonDB (версия 6.0): модель регуляции генов Escherichia coli K-12 за пределами транскрипции, активные (экспериментальные) аннотированные промоторы и навигация Textpresso. Nucleic Acids Res.2008; 36 (выпуск базы данных): D120 – D124. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гарсия Х.Г., Филлипс Р. Количественный анализ простой функции ввода-вывода подавления. Proc Natl Acad Sci USA. 2011; 108: 12173–12178. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гарсия Х.Г., Ли Х.Дж., Бодикер Дж. К., Филлипс Р. Сравнение и калибровка различных репортеров для количественного анализа экспрессии генов. Biophys J. 2011; 101: 535–544. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gardner TS, Cantor CR, Collins JJ.Конструирование генетического переключателя на Escherichia coli. Природа. 2000; 403: 339–342. [PubMed] [Google Scholar]
- Gaston K, Bell A, Kolb A, Buc H, Busby S. Строгие требования к интервалам для активации транскрипции с помощью CRP. Клетка. 1990; 62: 733–743. [PubMed] [Google Scholar]
- Герц Дж., Сиггиа Э.Д., Коэн Б.А. Анализ комбинаторной цис-регуляции в синтетических и геномных промоторах. Природа. 2009; 457: 215–218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Geserick C, Meyer HA, Haendler B.Роль элементов ответа ДНК как аллостерических модуляторов функции стероидных рецепторов. Mol Cell Endocrinol. 2005; 236: 1–7. [PubMed] [Google Scholar]
- Haugen SP, Ross W., Gourse RL. Успехи в распознавании бактериального промотора и его контроле с помощью факторов, не связывающих ДНК. Nat Rev Microbiol. 2008; 6: 507–519. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hochschild A, Dove SL. Белковые контакты, активирующие и подавляющие прокариотическую транскрипцию. Клетка. 1998. 92: 597–600.[PubMed] [Google Scholar]
- Хоган М.Э., Остин Р.Х. Важность жесткости ДНК в специфичности связывания белок-ДНК. Природа. 1987. 329: 263–266. [PubMed] [Google Scholar]
- Joung JK, Le LU, Hochschild A. Синергетическая активация транскрипции белком рецептора цАМФ Escherichia coli. Proc Natl Acad Sci USA. 1993; 90: 3083–3087. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Joung JK, Koepp DM, Hochschild A. Синергетическая активация транскрипции белком lambda cI бактериофага и E.coli рецепторный белок цАМФ. Наука. 1994; 265: 1863–1866. [PubMed] [Google Scholar]
- Kalodimos CG, Bonvin AM, Salinas RK, Wechselberger R, Boelens R, Kaptein R. Пластичность в узнавании белок-ДНК: lac-репрессор взаимодействует со своим естественным оператором 01 посредством альтернативных конформаций связывания с ДНК домен. EMBO J. 2002; 21: 2866–2876. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kalodimos CG, Boelens R, Kaptein R. К интегрированной модели распознавания ДНК-белок, выведенной из исследований ЯМР репрессорной системы Lac.Chem Rev.2004; 104: 3567–3586. [PubMed] [Google Scholar]
- Klumpp S, Zhang Z, Hwa T. Глобальные эффекты, зависящие от скорости роста, на экспрессию генов в бактериях. Клетка. 2009. 139: 1366–1375. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kuhlman T, Zhang Z, Saier MH, Jr, Hwa T. Комбинаторный контроль транскрипции лактозного оперона Escherichia coli. Proc Natl Acad Sci USA. 2007; 104: 6043–6048. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lee DH, Schleif RF. In vivo петель ДНК в araCBAD: ограничения по размеру и спиральный повтор.Proc Natl Acad Sci USA. 1989; 86: 476–480. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lefstin JA, Yamamoto KR. Аллостерические эффекты ДНК на регуляторы транскрипции. Природа. 1998. 392: 885–888. [PubMed] [Google Scholar]
- Leung TH, Hoffmann A, Baltimore D. Один нуклеотид в сайте kappaB может определять кофакторную специфичность димеров NF-kappaB. Клетка. 2004. 118: 453–464. [PubMed] [Google Scholar]
- Lilja AE, Jenssen JR, Kahn JD. Геометрические и динамические требования для образования петель, упаковки и разворачивания ДНК при активации E.coli транскрипция glnAp2 с помощью NtrC. J Mol Biol. 2004. 342: 467–478. [PubMed] [Google Scholar]
- Лопес П.Дж., Гиллерес Дж., Соуза Р., Дрейфус М. О механизме ингибирования РНК-полимеразы фага Т7 с помощью lac-репрессора. J Mol Biol. 1998. 276: 861–875. [PubMed] [Google Scholar]
- Ma B, Tsai CJ, Pan Y, Nussinov R. Почему связывание белков с ДНК или белков с белками не обязательно означает функцию? ACS Chem Biol. 2010. 5: 265–272. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мадан Бабу М., Тейхманн С.А.Функциональные детерминанты факторов транскрипции Escherichia coli: семейства белков и сайты связывания. Тенденции Genet. 2003. 19: 75–79. [PubMed] [Google Scholar]
- Мао К., Карлсон Н.Г., Литтл Дж. У. Кооперативные ДНК-белковые взаимодействия. Эффекты изменения расстояния между соседними сайтами связывания. J Mol Biol. 1994; 235: 532–544. [PubMed] [Google Scholar]
- Мартин Р.Г., Бартлетт Э.С., Рознер Дж.Л., Уолл М.Э. Активация регулона marA / soxS / rob Escherichia coli в ответ на концентрацию активатора транскрипции.J Mol Biol. 2008. 380: 278–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Meijsing SH, Pufall MA, So AY, Bates DL, Chen L, Yamamoto KR. Последовательность сайта связывания ДНК определяет структуру и активность рецептора глюкокортикоидов. Наука. 2009. 324: 407–410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Monsalve M, Calles B, Mencía M, Salas M, Rojo F. Активация или репрессия транскрипции с помощью белка p4 фага psi 29 зависит от силы взаимодействий РНК-полимеразы с промотором .Mol Cell. 1997; 1: 99–107. [PubMed] [Google Scholar]
- Monsalve M, Mencía M, Salas M, Rojo F. Белок p4 репрессирует промотор A2c фага phi 29, взаимодействуя с альфа-субъединицей РНК-полимеразы Bacillus subtilis. Proc Natl Acad Sci USA. 1996; 93: 8913–8918. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мюллер-Хилл Б. Оперон lac : краткая история генетической парадигмы. Берлин, Нью-Йорк: Вальтер де Грюйтер; 1996. [Google Scholar]
- Müller J, Oehler S, Müller-Hill B.Репрессия промотора lac в зависимости от расстояния, фазы и качества вспомогательного оператора lac . J Mol Biol. 1996; 257: 21–29. [PubMed] [Google Scholar]
- Newlands JT, Ross W, Gosink KK, Gourse RL. Факторнезависимая активация транскрипции рРНК Escherichia coli. II. характеристика комплексов промоторов rrnB P1, содержащих или не содержащих активаторную область выше, с РНК-полимеразой Escherichia coli. J Mol Biol. 1991; 220: 569–583. [PubMed] [Google Scholar]
- Новак Б., Тайсон Дж. Дж.Принципы построения биохимических осцилляторов. Nat Rev Mol Cell Biol. 2008; 9: 981–991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pavco PA, Steege DA. Растяжение РНК-полимеразой Escherichia coli блокируется in vitro сайт-специфическим ДНК-связывающим белком. J Biol Chem. 1990; 265: 9960–9969. [PubMed] [Google Scholar]
- Павко П.А., Стидж Д.А. Характеристика удлиняющихся РНК-полимераз Т7 и SP6 и их реакции на блокировку, создаваемую сайт-специфическим ДНК-связывающим белком.Nucleic Acids Res. 1991; 19: 4639–4646. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пташне М., Ганн А. Гены и сигналы. Нью-Йорк: издательство лаборатории Колд-Спринг-Харбор; 2002. [Google Scholar]
- Raveh-Sadka T, Levo M, Shabi U, Shany B., Keren L, Lotan-Pompan M, Zeevi D, Sharon E, Weinberger A, Segal E. нуклеосомы, неблагоприятные для последовательностей. Nat Rev Genet. 2012 г. http://dx.doi.org/10.1038/ng.2305. [PubMed]
- Рохо Ф.Подавление инициации транскрипции у бактерий. J Bacteriol. 1999; 181: 2987–2991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Romanuka J, Folkers GE, Biris N, Tishchenko E, Wienk H, Bonvin AM, Kaptein R, Boelens R. Специфичность и близость репрессора Lac к вспомогательным операторам O2 и O3 объясняются структурой их комплексов белок-ДНК. J Mol Biol. 2009; 390: 478–489. [PubMed] [Google Scholar]
- Roy S, Semsey S, Liu M, Gussin GN, Adhya S. GalR репрессирует galP1 путем ингибирования определяющего скорость образования открытого комплекса посредством контакта с РНК-полимеразой: мутант отрицательного контроля GalR.J Mol Biol. 2004. 344: 609–618. [PubMed] [Google Scholar]
- Ryu S, Fujita N, Ishihama A, Adhya S. GalR-опосредованная репрессия и активация гибридного промотора lacUV5: дифференциальные контакты с РНК-полимеразой. Ген. 1998. 223: 235–245. [PubMed] [Google Scholar]
- Санчес А., Осборн М.Л., Фридман Л.Дж., Кондев Дж., Геллес Дж. Механизм репрессии транскрипции на бактериальном промоторе путем анализа одиночных молекул. EMBO J. 2011; 30: 3940–3946. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Schlax PJ, Capp MW, Record MT., Jr Ингибирование инициации транскрипции lac-репрессором. J Mol Biol. 1995; 245: 331–350. [PubMed] [Google Scholar]
- Скалли К.М., Якобсон Е.М., Джепсен К., Луньяк В., Виадиу Х., Каррьер С., Роуз Д.В., Хушманд Ф., Аггарвал А.К., Розенфельд М.Г. Аллостерические эффекты сайтов ДНК Pit-1 на долгосрочную репрессию в спецификации типов клеток. Наука. 2000; 290: 1127–1131. [PubMed] [Google Scholar]
- Сигал Э., Видом Дж. От последовательности ДНК до транскрипционного поведения: количественный подход. Nat Rev Genet.2009. 10: 443–456. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сегал Э., Равех-Садка Т., Шредер М., Уннерстолл Ю., Галлия Ю. Прогнозирование паттернов экспрессии на основе регуляторной последовательности в сегментации дрозофилы. Природа. 2008; 451: 535–540. [PubMed] [Google Scholar]
- Стрейни С.Б., Кротерс Д.М. Lac-репрессор — это временный белок, активирующий ген. Клетка. 1987. 51: 699–707. [PubMed] [Google Scholar]
- Цай Т.Ю., Чой Ю.С., Ма В., Помереннинг Дж. Р., Танг С., Феррелл Дж., Младший. Надежные, настраиваемые биологические колебания из взаимосвязанных контуров положительной и отрицательной обратной связи.Наука. 2008. 321: 126–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Вилар Дж. М., Лейблер С. Образование петель ДНК и физические ограничения регуляции транскрипции. J Mol Biol. 2003; 331: 981–989. [PubMed] [Google Scholar]
- Voss TC, Schiltz RL, Sung MH, Yen PM, Stamatoyannopoulos JA, Biddie SC, Johnson TA, Miranda TB, John S, Hager GL. Динамический обмен в регуляторных элементах во время ремоделирования хроматина лежит в основе механизма вспомогательной нагрузки. Клетка. 2011; 146: 544–554. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wall ME, Markowitz DA, Rosner JL, Martin RG.Модель активации транскрипции MarA в Escherichia coli. PLoS Comput Biol. 2009; 5: e1000614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Zinzen RP, Girardot C, Gagneur J, Braun M, Furlong EE. Комбинаторное связывание предсказывает пространственно-временную цис-регуляторную активность. Природа. 2009; 462: 65–70. [PubMed] [Google Scholar]
Набор задач молекулярной генетики прокариот |
| А. | гены индуцибельных ферментов метаболизма лактозы |
| Б. | гены репрессора, регуляторного белка |
| С. | ген РНК-полимеразы |
| Д. | промотор, сайт связывания РНК-полимеразы |
| E. | оператор, сайт связывания репрессора |
Учебник
Модель Operon
| Оперон — это скоординированно регулируемая единица транскрипции у бактерий.Модель оперона была предложена Джейкобом, Монодом и Уоллманом на основе их генетических и биохимических исследований требующих лактозы мутаций E. coli . Оперон — это единица бактериальной хромосомы, состоящая из следующих компонентов: |
1. Регуляторный ген
|
2. Оператор
|
3. Промоутер
|
4. Структурные гены
|
Биологический проект
Университет Аризоны
Четверг, 17 октября 1996 г.
Связаться с командой разработчиков
http: // www.biology.arizona.edu
Авторские права на все содержимое © 1998-99. Все права защищены.
Регуляция экспрессии генов
Регуляция экспрессии генов
Постановление
Экспрессия гена
Сотовая связь есть
под влиянием клеточной среды. Достигнута адаптация к конкретным условиям
регулируя экспрессию генов, кодирующих необходимые ферменты и белки
для выживания в определенной среде.Факторы, влияющие на экспрессию генов
включают питательные вещества, температуру, свет, токсины, металлы, химические вещества и сигналы
из других ячеек. Нарушения в регуляции экспрессии генов могут вызвать
различные человеческие расстройства и болезни.
Положение в
Прокариоты
Бактерии имеют простой
общий механизм координации регуляции генов, кодирующих продукты
вовлечены в набор связанных процессов.Кластер генов и промотор, плюс
дополнительные последовательности, которые вместе функционируют в регуляции, называются опероном.
Оперон лактозы
( lac оперон)
Оперон лактозы
из E. coli кодирует фермент b-галактозидазу
который гидролизует лактозу до галактозы и глюкозы.
Оперон lac
содержит три цистрона или фрагмента ДНК, которые кодируют функциональный белок.В
белки, кодируемые цистронами, могут функционировать отдельно или как субъединицы более крупных ферментов.
или структурные белки.
Ген Z кодирует
для b-галактозидазы. Ген Y кодирует пермеазу
что облегчает перенос лактозы в бактерии. Ген А кодирует
тиогалактозид трансацетилаза, функция которой неизвестна. Все три из них
гены транскрибируются как одна полицистронная мРНК. Полицистронная РНК содержит
несколько генетических сообщений, каждое со своей собственной инициацией и окончанием трансляции
сигналы.
Постановление
lac Operon
Деятельность
промотор, который контролирует экспрессию оперона lac , регулируется
двумя разными белками. Один из белков не позволяет РНК-полимеразе
транскрибирует (отрицательный контроль), другой усиливает связывание РНК-полимеразы
к промотору (положительный контроль).
отрицательный
Управление lac Operon
Белок, подавляющий
транскрипция оперона lac представляет собой тетрамер с четырьмя идентичными субъединицами
назвал lac репрессором.Репрессор lac кодируется lacI
Ген, расположенный перед опероном lac и имеющий собственный промотор. Выражение
гена lacI не регулируется и очень низкие уровни lac
репрессоры непрерывно синтезируются. Гены, экспрессия которых не регулируется
называются конститутивными генами.
При отсутствии лактозы
репрессор lac блокирует экспрессию оперона lac путем связывания
к ДНК в сайте, называемом оператором, который находится ниже промотора
и перед сайтом инициации транскрипции.Оператор состоит из
специфическая нуклеотидная последовательность, которая распознается репрессором, который связывает
очень сильно, физически блокируя (удушая) инициацию транскрипции.
Репрессор lac
имеет высокое сродство к лактозе. Когда присутствует небольшое количество лактозы,
lac свяжет его, вызывая диссоциацию от оператора ДНК, таким образом
освобождение оперона для экспрессии гена.Субстраты, вызывающие
диссоциируют от своих операторов, называются индукторами, а гены, которые регулируются
такие репрессоры называются индуцибельными генами.
Положительно
Управление lac Operon
Хотя лактоза может
индуцируют экспрессию оперона lac , уровень экспрессии очень
низкий. Причина этого в том, что оперон lac подвержен катаболизму.
подавление или снижение экспрессии генов, вызванное ростом в присутствии
глюкозы.Глюкоза очень легко метаболизируется, поэтому является предпочтительным источником топлива.
над лактозой, поэтому имеет смысл предотвратить экспрессию оперона lac
когда присутствует глюкоза.
Сила промоутера
определяется его способностью связывать РНК-полимеразу и образовывать открытый комплекс.
Промотор для оперона lac слабый и, следовательно, lac
оперон плохо транскрибируется при индукции. Есть сайт привязки, апстрим
от промотора для белка, называемого белком-активатором катаболита (CAP).Когда белок CAP связывается, он искажает ДНК, так что полимераза РНК может
связываются более эффективно, поэтому транскрипция оперона lac в значительной степени
повышенная. Для связывания CAP сначала должен связывать циклический AMP (cAMP), второй
мессенджер синтезируется из АТФ ферментом аденилатциклаза.
В наличии
уровни циркулирующего цАМФ глюкозы очень низкие, и, следовательно, начало
транскрипция оперона lac очень низкая.По мере снижения уровня глюкозы
концентрация цАМФ увеличивает активацию CAP, которая, в свою очередь, связывается с
Сайт CAP, стимулирующий транскрипцию. Комплекс цАМФ-CAP называется положительным
регулятор.
Арабиноза
Оперон
Арабиноза — пятиуглеродный
сахар, который может служить источником энергии и углерода для E. coli . Арабиноза
сначала должен быть преобразован в рибулозо-5-фосфат, прежде чем он сможет метаболизироваться.Оперон арабинозы имеет три гена: araB , araA и araD .
которые кодируют три фермента для осуществления этого преобразования. Четвертый ген, araC ,
который имеет собственный промотор, кодирует регуляторный фактор, называемый белком С.
Регулирующие сайты
оперона ara включают четыре сайта, которые связывают белок C и один
Сайт связывания CAP. Сайты araO 1 и araO 2
находятся выше промотора и сайтов связывания САР.Два других белка C
сайты связывания, называемые araI 1 и araI 2 являются
расположен между сайтом связывания CAP и промотором.
отрицательный
Управление araC Operon
В отсутствие арабинозы
димеры белка C связываются с araO 2 , araO 1
и ARI 1 .Белки C связаны с araO 2
и araI 1 связываются друг с другом, вызывая ДНК между
они образуют петлю, эффективно блокирующую транскрипцию оперона.
Положительно
Управление araC Operon
Белок C связывает
арабинозу и претерпевает конформационные изменения, которые позволяют ей также связывать
сайты araO 2 и araI 2 .Это результаты
в создании другой петли ДНК, которая образуется в результате взаимодействия
белков С, связанных с araO 1 и araO 2
места.
Формирование этого
петля стимулирует транскрипцию гена araC , что приводит к дополнительному
Синтез белка C, таким образом, белок C саморегулирует свой собственный синтез. В
в отсутствие глюкозы образуется цАМФ-CAP, который связывается с сайтом CAP.C протеин
связаны на сайтах araI 1 и araI 2 сайтов взаимодействуют
со связанным CAP, позволяющим РНК-полимеразе инициировать транскрипцию из
ara промотор оперона.
Триптофан
Оперон
E. coli банка
синтезировать все 20 природных аминокислот. Синтез аминокислот потребляет
много энергии, поэтому, чтобы не тратить ее впустую, опероны, кодирующие амино
синтез кислоты жестко регулируется.Оперон trp состоит из пяти
гены, trpE , trpD , trpC , trpB и trpA , что
кодируют ферменты, необходимые для синтеза триптофана.
Оперон trp
регулируется двумя механизмами: отрицательным корепрессией и ослаблением. Наиболее
Оперонов, участвующих в синтезе аминокислот, регулируются этими двумя механизмами.
отрицательный
Corepression
Оперон trp отрицательно
контролируется репрессором trp , продуктом гена trpR .В
trp Репрессор связывается с оператором и блокирует транскрипцию оперона.
Однако, чтобы привязаться к оператору, репрессор должен сначала привязаться к Trp.
следовательно, триптофан является корепрессором. При отсутствии Трп репрессор трп
диссоциирует и инициируется транскрипция оперона trp .
Затухание
Регулирует затухание
прекращение транскрипции в зависимости от концентрации триптофана.При низких уровнях trp образуется мРНК полной длины, при высоких уровнях транскрипции
оперона trp преждевременно останавливается. Затухание работает по муфте
транскрипция на перевод. Прокариотическая мРНК не требует обработки и
поскольку у прокариот нет ядра, трансляция мРНК может начаться до транскрипции
завершено. Следовательно, регулирование экспрессии генов посредством аттенуации уникально.
прокариотам.
а. Затухание опосредовано
за счет образования одной из двух возможных структур стержень-петля в сегменте 5 ‘
оперона trp в мРНК.
г. Если концентрация триптофана
низки, то трансляция лидерного пептида медленная и транскрипция
оперон trp опережает трансляцию. Это приводит к образованию незавершенного
структура стебель-петля между областями 2 и 3 в 5′-сегменте мРНК. Транскрипция
оперона trp завершается.
г. Если концентрация триптофана
высокие рибосома быстро транслирует лидерный пептид мРНК.Потому что перевод
происходит быстро, рибосома покрывает область 2, так что она не может прикрепляться
в область 3. Следовательно, формирование структуры стержень-петля между областями
3 и 4, и транскрипция прекращается.
Постановление
Экспрессия генов у эукариот
Генетическая информация
клетки человека в тысячу раз больше, чем прокариотическая клетка.
Ситуация еще больше усложняется количеством типов клеток и тем фактом, что
каждый тип клеток должен выражать определенное подмножество генов в разных точках
в развитии организмов.Регулирование экспрессии генов, чтобы конкретный
подмножество генов экспрессируется в конкретной ткани в определенных точках развития
очень сложно. Эта повышенная сложность регулирования поддается
неисправности, вызывающие заболевание. Три способа, которыми эукариоты регулируют экспрессию генов
будут обсуждаться: изменение содержания или положения гена, регуляция транскрипции
и альтернативный процессинг РНК.
1. Переделка
содержания или позиции гена
Номер копии
ген или его расположение в хромосоме могут сильно повлиять на уровень его экспрессии.Содержание или расположение гена может быть изменено путем амплификации, уменьшения или уменьшения гена.
перестановка.
Ген
Усиление
Выражение
конкретный ген может быть увеличен путем увеличения числа его копий. Гистоновые белки
и рРНК в больших количествах необходимы почти всем эукариотическим клеткам, поэтому
гены, кодирующие гистоны и рРНК, существуют в постоянно амплифицированном состоянии.Амплификация гена может вызвать проблемы при использовании химиотерапевтических препаратов.
Метотрексат ингибирует дигидрофолатредуктазу, фермент, отвечающий за регенерацию
фолаты, используемые в синтезе нуклеотидов. Опухолевые клетки часто становятся устойчивыми
к препарату, потому что ген, кодирующий дигидрофолатредуктазу, амплифицируется
в несколько сотен раз, что приводит к большему производству ферментов, чем может обрабатывать лекарство.
Ген
Уменьшение
Ген, экспрессия которого
требуется только в определенной точке развития или в конкретной ткани
может быть отключен уменьшением гена.По мере того как ретикулоциты превращаются в эритроциты
все их гены теряются по мере разрушения ядра.
Ген
Перестановки
Генная перестройка
используется для генерации каждого из генов, кодирующих миллионы различных антител
которые производятся В-клетками. Иногда происходят плохие генные перестройки, которые приводят к
к неправильной регуляции генов. Это часто происходит в раковых клетках.Перемещение
сегмента от хромосомы 8 до хромосом, кодирующих иммуноглобулины, приводит
к активации гена, который превращает здоровые В-клетки в лимфому Беркитта
клетки (нерегулируемые пролиферирующие В-клетки).
2. Транскрипция
Постановление
Через
Хромосомная упаковка
регионов каждого из
разные хромосомы упакованы либо как гетерохроматин, либо как эухроматин.В гетерохроматине ДНК очень плотно конденсирована и недоступна.
к транскрипционному аппарату, следовательно, гетерохроматин транскрипционно
неактивный. У женщин одна из двух Х-хромосом полностью повреждена.
инактивируется путем упаковки в гетерохроматин с образованием тельца Барра. В
Остатки Cys в ДНК в гетерохроматине сильно метилированы, что позволяет предположить
что метилирование может играть роль в поддержании гетерохроматина.Наркотики
которые препятствуют метилированию, вызывают активацию ранее неактивных генов
обнаружен в гетерохроматине.
В эухроматине
ДНК не так конденсирована и доступна для механизма транскрипции. В
области хромосомы, которые поддерживаются как гетеро- и эухроматин, могут
варьируются в зависимости от клетки. Это может позволить клеткам определенных тканей
для экспрессии определенного подмножества генов, необходимых для функционирования тканей.
Через
Индивидуальные гены
Транс-действующий
Элементы
белков, которые участвуют
в регуляции экспрессии генов часто называют транс действующими элементами.По меньшей мере
100 различных белков, многие из которых специфичны для регуляции определенного гена,
известны. Другие играют более общую роль в регуляции экспрессии генов в
способом, аналогичным активации многочисленных прокариотических генов с помощью CAP-cAMP
сложный. У транс-действующих факторов есть несколько доменов, необходимых для активности и
может включать ДНК-связывающий, активирующий транскрипцию и лиганд-связывающий домены.
Связывание ДНК
Домены
ДНК-связывающих доменов
распознают специфические последовательности ДНК в регуляторных областях гена.Связывание ДНК
домены регуляторного белка обычно состоят из одного из трех мотивов: спираль-поворот-спираль,
цинковый палец или лейциновая молния. ДНК-связывающие белки, обладающие этими мотивами
связываются с высоким сродством к их сайтам распознавания и с низким сродством к
другая ДНК. Очень небольшая часть белка контактирует с ДНК через
Н-связи и ван-дер-ваальсовы взаимодействия между боковыми цепями аминокислот и
функциональные группы в большой бороздке и фосфатном скелете ДНК.Остальная часть белка участвует в правильном позиционировании ДНК-связывающей
домен и в установлении белок-белковых контактов с другими транскрипционными белками.
В
Мотив Helix-Turn-Helix
белков с этим
мотив образуют симметричные димеры, распознающие симметричную палиндромную последовательность ДНК.Каждый мономер димера содержит область, в которой удерживаются две спирали α.
под углом 90 градусов друг к другу поворотом четырех аминокислот. Один комплект спиралей
контактирует примерно с пятью парами оснований в большой канавке. Другой набор
сидит на фосфатной основе и помогает правильно расположить набор спиралей
который входит в большую канавку.
В
Мотив с цинковыми пальцами
Белков, обладающих
этот мотив содержит от 2 до 9 повторяющихся доменов, каждый из которых сосредоточен на
тетраэдрически координированный ион цинка.Каждый координированный цинком домен образует петлю
Эта петля, содержащая а-спираль, называется цинковым пальцем.
Есть два типа цинковых пальцев: палец C 2 H 2 и
палец C x .
C 2 H 2 Палец:
Три пальца взаимодействуют
с большой бороздкой и оберткой вокруг ДНК. Многие факторы транскрипции имеют
этот тип домена.
C x Палец:
белков с этим
мотивы связываются в виде димеров с большой бороздкой ДНК.Многие стероидные рецепторы
есть домен этого типа.
В
Лейциновая застежка-молния
белков с этим
тип мотива имеют амфипатическую а-спираль на их
карбоксильный конец. Одна сторона спирали состоит из гидрофобных групп, обычно
лейцин, которые повторяются в каждой седьмой позиции на протяжении нескольких витков спирали.Другая грань состоит из заряженных и полярных групп.
белков с этим
мотивы связываются в виде димеров с большой бороздкой ДНК. Две а-спирали
каждого плеча входят в большую канавку и охватывают двойную спираль. Несколько
онкогены используют этот тип мотива.
Активация транскрипции
Домены
Эти домены обычно
действуют отдельно и независимо от ДНК-связывающих доменов.Активация транскрипции
домены усиливают транскрипцию, физически не взаимодействуя с другими регуляторными
белки и / или с РНК-полимеразой. Фактические механизмы, с помощью которых эти домены
активация или усиление транскрипции неизвестны.
Связывание лиганда
Домены
Стероидные гормоны щитовидной железы
гормоны и ретиноевая кислота являются примерами лигандов, активирующих транскрипцию
путем связывания со специфическим доменом рецепторного белка.При связывании рецептора
претерпевает конформационное изменение, которое позволяет ему связывать ДНК. Однажды привязанный к
ДНК рецепторный белок может активировать или подавлять транскрипцию мишени
ген.
цис-действие
Элементы
Элементы цис-действия
представляют собой последовательности ДНК, которые распознаются и связываются транс-действующими элементами
которые регулируют транскрипцию. Есть два основных типа цис-действующих элементов:
промоторы и регуляторные элементы.
Промоутеры
Промоутеры — это сайты
где РНК-полимераза должна связываться с ДНК, чтобы инициировать транскрипцию
(см. лекцию «Синтез и обработка РНК»). Скорость или эффективность
Использование промотора РНК-полимеразой зависит от регуляторных элементов.
Нормативный
Элементы
Нормативные элементы
представляют собой специфические последовательности ДНК, которые распознаются и связываются транс-действующими
элементы, которые стимулируют или подавляют экспрессию определенного гена.Там
бывают двух типов: энхансеры и ответные элементы.
Усилители есть
регуляторные элементы, которые увеличивают или подавляют скорость транскрипции генов.
Ответные элементы
являются регуляторными последовательностями, которые способствуют скоординированной регуляции группы
генов. Определенные лиганды, такие как стероидные гормоны и цАМФ, связываются со своими рецепторами.
которые, в свою очередь, связываются со своим отвечающим элементом, чтобы активировать или ингибировать транскрипцию.
3. Альтернатива
Обработка
Альтернатива
Стартовые сайты
Инициирование транскрипции
в альтернативном стартовом сайте размещает другой экзон на 5′-конце транскрипта.
Примеры генов, которые используют альтернативные стартовые сайты в качестве формы регуляции, включают:
амилаза, миозин и алкогольдегидрогеназа.
Альтернатива
Сайты полиаденилирования
Иммуноглобин (антитело)
тяжелые цепи используют альтернативный сайт полиаденилирования, чтобы влиять на длину
стенограммы.Более длинный транскрипт кодирует m m
форма, которая локализуется на клеточных мембранах лимфоцитов, более короткий транскрипт
кодирует секретируемую форму, m s .
Альтернатива
Участки сращивания
Альтернативный стык
сайты используются для генерации подобных белков с тканеспецифическими функциями, называемыми
изоформы. Многие пептидные гормоны существуют в виде изоформ, таких как ген кальцитонина.
который дифференцированно сращивается с образованием кальцитонина в щитовидной железе и кальцитонина
ген-родственный пептид в нейронах.
Регламент
стабильности мРНК
Стабильность мРНК
это довольно вариабельная форма от гена к гену. Эти вариации стабильности определяют
время, в течение которого мРНК доступна для трансляции и, следовательно, количество
белок, который синтезируется. Период полураспада мРНК варьируется от 10 часов до минут.
Последовательности в 3′-нетранслируемой области мРНК, которые служат сигналами для быстрого
деградация была идентифицирована в некоторых мРНК с очень коротким периодом полураспада.Длина поли-А-хвоста также влияет на стабильность мРНК с более длинными хвостами.
имеют более длительный период полураспада.
© Др.
Ноэль Штурм 2020
Заявление об ограничении ответственности: Взгляды и мнения, выраженные на неофициальных страницах штата Калифорния
Университет, преподаватели, сотрудники или студенты университета Домингес Хиллс являются строго такими же
авторы страницы. Содержание этих страниц не проверялось или
одобрен Калифорнийским государственным университетом, Домингес-Хиллз.
Типы положений о генах
Типы регулирования генов
Генная регуляция может происходить на разных этапах. Количество
продукт зависит от:
- скорость синтеза (транскрипции) мРНК,
- деградация мРНК,
- синтез (трансляция) белков и др.
Прокариоты обычно контролируют транскрипцию
- Конститутивные гены всегда экспрессируются
- Имеет тенденцию быть жизненно важным для основных функций клеток (часто называемых
гены домашнего хозяйства)
- Имеет тенденцию быть жизненно важным для основных функций клеток (часто называемых
- Регулируемые гены могут быть индуцибельными или
репрессируемый - Индуцибельные гены обычно выключены, но могут быть включены
при наличии субстрата - Общие для катаболических генов (т.е. для использования
отдельных ресурсов) ‘ - Оперон lac индуцируется.
- Общие для катаболических генов (т.е. для использования
- Репрессируемые гены обычно включены, но могут быть отключены
когда конечный продукт в изобилии - Общие для генов биосинтеза
- Индуцибельные гены обычно выключены, но могут быть включены
Дополнительная терминология
Репрессоры и Активаторы — это белки, связывающие
к ДНК и контролю транскрипции.Говорят, что эти гены
подавляемый или индуцируемый.
Ингибиторы и Индукторы небольшие
«эффекторные» молекулы, которые связываются с репрессорами или
активаторы.
Хотя терминологии много, концепции
довольно просто: различные факторы взаимодействуют, чтобы включить или выключить вещи.
Например, репрессоры просто действуют как препятствие, чтобы заблокировать
транскрипция. Если другая молекула (индуктор) мешает
репрессор, они не связывают ДНК и транскрипция продолжается
как обычно.
оперонов
- У прокариот функционально родственные гены регулируются как
единица, называемая опероном . - Опероны состоят из:
- Несколько структурных генов
- ОДИН промоутер и один терминатор
- Пункт управления (оператор)
- Отдельный ген-регулятор (кодирует белок, связывающий
оператору)
Обзор lac Operon
- Ген обычно выключен
- Транскрипция отсутствует, потому что репрессор связывается с
узел управления - Когда присутствует лактоза, она инактивирует репрессор,
разрешив начало транскрипции.Это создает как lacZ (to
расщепить лактозу) и lacY (впустить в
ячейка) - Когда лактоза израсходована, репрессор снова может связываться
к ДНК и остановить транскрипцию. - Глюкоза должна отсутствовать. Если присутствует глюкоза, транскрипция
не запускается.
Клетки быстро реагируют на доступные сахара:
Активность B-галактозидазы повышается почти сразу после
переходят на лактозу в качестве единственного источника углерода и быстро прекращаются
после добавления глюкозы.
См. И изучите рис. 16.5 и 16.7, чтобы увидеть, как
нормальный lac-оперон реагирует на различные типы
сахара.
Помните, что, вероятно, лучше выучить
понятия «репрессор» и «индуцибельный ген»
и «оперон», а затем используйте логику, чтобы применить это к lac,
а не просто запоминание генов.
Полярные мутации
В полицистронной мРНК все, что преждевременно останавливается
трансляция также повлияет на все другие гены, расположенные ниже по течению
оперон
Использование генетики для определения лак
оперон
- Джейкоб и Моно идентифицировали несколько мутаций в генах
лак оперон - лак Z —, лак O c ,
и т.п. - использовали штаммы F ‘, которые имели различные комбинации мутантных
и гены дикого типа - Эти штаммы F ‘были «частичными диплоидами» для
лак оперон.
Первый взгляд на отдельные мутации:
Какие эффекты вы предсказываете для мутаций в B-галактозидазе,
lacZ? В качестве подхода задайте такие вопросы:
- Что делает lacZ?
- Каковы будут последствия, если
нефункциональный? - Будет ли мутация доминантной или рецессивной в частичных
диплоиды?
В этом случае мутант lacZ не сможет метаболизировать
лактоза, независимо от того, индуцирован ли ген.Но это будет
рецессивный: если есть другая функция; копия на плазмиде,
B-gal. должно производиться нормально.
А как насчет репрессорного локуса lacI?
- Какие эффекты вы прогнозируете для мутаций в регуляторе?
ген lac I — ? - Что делает lac I?
- Каковы будут последствия, если
нефункциональный? - Будет мутация доминантной или рецессивной?
См. Рис.16.9, где показаны эффекты
lacI — мутация
Мутации в регуляторном гене lac I влияют на гены
обе молекулы ДНК, так что это трансдоминанта. То есть
типичен для связывающих белков и других диффундирующих веществ.
Тест модели
Джейкоб и Моно предсказали, что будет третий тип
мутация: мутации в операторе, lac O
- Какие эффекты они должны иметь?
- Что делает оператор?
- Каковы будут последствия, если
нефункциональный? - Будет мутация доминантной или рецессивной?
Фиг.16.8 показывает эффекты оператора
мутации.
Мутации в операторе влияют только на гены, связанные с ним на
та же молекула ДНК, поэтому говорят, что они цис-доминантные .
Это типично для элементов контроля транскрипции, таких как промоторы,
пр.
Еще одна мутация lacI: суперепрессоры
(LACI S )
У этих мутантов репрессор всегда активен, независимо от того,
индуктор (аллолактоза) присутствует.
Помните, у репрессоров есть два сайта: один для связывания ДНК и
другие для связывания аллолактозы. На каком сайте, по вашему мнению, произошла мутация?
lacI с
А как насчет глюкозы?
Если присутствует глюкоза, гены lac молчат
Необходим положительный активатор
CAP-cAMP, помогает РНК-полимеразе связываться с
промоутер
Если уровень глюкозы низкий, цАМФ накапливается в клетках и активируется
КРЫШКА
Система CAP-cAMP — это отдельный регулятор lac,
который действует по совершенно другому механизму.Скорее, чем
блокируя транскрипцию, это активатор, необходимый для
эффективное связывание промотора с ДНК.
Экспрессия прокариотического гена
Первая система управления производством ферментов, разработанная на молекулярном
уровень описал контроль ферментов, которые производятся в ответ на
наличие сахарной лактозы в клетках E. coli . Работа выполнена
Якоба и Моно, за что они были удостоены Нобелевской премии.Следующие
это путь, который приводит к производству глюкозы и галактозы.
Лактоза -----------------------------------> Глюкоза + галактоза
ß- галактозидаза
Некоторые белки участвуют в метаболизме лактозы в клетке E. coli .
Они есть:
- ß-галактозидаза — превращает лактозу в глюкозу и галактозу
- ß-галактозид пермеаза — переносит лактозу в клетку
- ß-галактозид трансацетилаза — функция неизвестна
Исследования с этой системой были значительно добавлены доступностью
конститутивных мутантов .Конститутивный мутант — это тот, в котором ген
продукт производится непрерывно, то есть нет контроля над его выражением.
У этих мутантов вышеупомянутые белки продуцировались все время по сравнению
к дикому типу, где белки появляются только в присутствии лактозы.
Таким образом, у этих мутантов мутация должна быть не в том гене, который ответственен за это.
для структурных генов.
Все гены, участвующие в контроле этого пути, расположены рядом с
друг друга на E.coli хромосома. Вместе они образуют оперон.
Ниже приводится генетическая структура оперона.
Схема управления для
lac Operon
I P O || Z | Y | А | _________________________________________________________
Контроллинг || Структурные гены
Регион
| lac Operon Gene | Функция гена |
|---|---|
Я | Ген репрессорного белка |
P | Промоутер |
O | Оператор |
лак Z | Ген ß-галактозидазы |
лак Y | Ген ß-галактозид пермеазы |
лак A | Ген ß-галактозид трансацетилазы |
Оперон — кластер структурных генов, которые выражаются как группа
и связанный с ними промоутер и оператор
Как работает эта система? Без лактозы в клетке белок-репрессор
связывается с оператором и предотвращает прохождение РНК-полимеразы в
три структурных гена.С лактозой в клетке, лактоза связывается с
репрессор. Это вызывает структурное изменение репрессора, и он теряет
его близость к оператору. Таким образом, РНК-полимераза может затем связываться с промотором.
и расшифровать структурные гены. В этой системе лактоза действует как эффектор
молекула.
Эффекторная молекула — молекула, которая взаимодействует с репрессором и
влияет на сродство репрессора к оператору
Обладая приведенной выше информацией, мы можем теперь предсказать эффект, который различные мутанты
будет иметь экспрессию гена оперона lac .
| Мутантный ген lac | Мутантный фенотип |
|---|---|
I — | конститутивное выражение, потому что оператор никогда не закрывается |
О — | конститутивная экспрессия, потому что белок-репрессор не может связываться |
-п. — | нет экспрессии оперона, потому что РНК-полимераза не может связываться |
лак Z — | отсутствие производства глюкозы или галактозы из лактозы |
лак Y — | нет индукции, потому что лактоза не попадает в клетку |
Катаболит Репрессия
lac Оперон
Лактоза не является предпочтительным источником углеводов для E.coli . Если лактоза
и глюкоза присутствуют, клетка будет использовать всю глюкозу до того, как
lac оперон включен. Этот тип управления называется
катаболическая репрессия . Для предотвращения метаболизма лактозы второй уровень
контроля экспрессии генов существует. Промотор оперона lac
имеет два места привязки. Один сайт — это место, где связывается РНК-полимераза.
Второе место — это сайт связывания комплекса между катаболитом .
белок-активатор (CAP) и циклический AMP (cAMP) .Связывание
комплекс CAP-cAMP с промоторным сайтом необходим для транскрипции
оперон lac . Наличие этого комплекса тесно связано с
при наличии глюкозы в клетке. Поскольку концентрация глюкозы
увеличивается количество цАМФ уменьшается. По мере уменьшения цАМФ количество
комплекса уменьшается. Это уменьшение комплекса инактивирует промотор,
и оперон lac выключен. Поскольку комплекс CAP-cAMP является
необходим для транскрипции, комплекс оказывает положительный контроль над
экспрессия оперона lac .
Copyright © 1997. Филип МакКлин
15: Положительный и отрицательный контроль экспрессии гена
Опероны
Оперон представляет собой кластер скоординированно регулируемых генов. Он включает структурных генов (обычно кодирующих ферменты), регуляторных генов (кодирующих, например, активаторы или репрессоры) и регуляторных сайтов (таких как промоторы и операторы). Тип контроля определяется реакцией оперона на отсутствие регуляторного белка.В случае отрицательного контроля гены оперона экспрессируются, если они не выключены репрессорным белком. Таким образом, оперон будет включаться конститутивно (гены будут экспрессироваться), когда репрессор будет инактивирован. В случае положительного контроля гены экспрессируются только тогда, когда активный белок-регулятор, например активатор, присутствует. Таким образом, оперон будет отключен, когда положительный регуляторный белок отсутствует или инактивирован.
Таблица 4.1.1 . Положительный и отрицательный контроль
Катаболические и биосинтетические опероны
Катаболические пути катализируют расщепление питательных веществ (субстрат для этого пути) для выработки энергии или, точнее, АТФ, энергетической валюты клетки. В отсутствие субстрата , нет причин для присутствия катаболических ферментов, и кодирующий их оперон репрессирован . В присутствии субстрата , когда ферменты необходимы, оперон индуцируется или подавляется.
| Оперон кодирует | Отсутствие | Эффект | Наличие | Эффект |
|---|---|---|---|---|
| катаболические ферменты | подложка | репрессированных | подложка | дерепрессированный (индуцированный) |
| ферменты биосинтеза | товар | индуцированный | товар | репрессированных |
Например, lac-оперон кодирует ферменты, необходимые для поглощения (пермеаза лактозы) и начального расщепления лактозы (дисахарид bD-галактозил-1-> 4-D-глюкоза) на галактозу и глюкозу (катализируемый b -галактозидаза).Эти моносахариды расщепляются на лактат (главным образом посредством гликолиза с образованием АТФ) и с лактата на СО2 (через цикл лимонной кислоты), производя НАДН, который входит в цепь переноса электронов для производства большего количества АТФ (окислительное фосфорилирование). Это может обеспечить жизнедеятельность бактериальной клетки. Однако исходные ферменты (лактозопермеаза и β-галактозидаза) необходимы только и экспрессируются только в присутствии лактозы и в отсутствие глюкозы. В присутствии лактозы-субстрата оперон включается, а при ее отсутствии оперон выключается.
Анаболические или биосинтетические пути используют энергию в форме АТФ и восстанавливающие эквиваленты в форме НАД (Ф) Н для катализирования синтеза клеточных компонентов (продукт ) из более простых материалов, например синтез аминокислот из малых дикарбоновых кислот (компонентов цикла лимонной кислоты). Если в клетке уже есть много продукта (в присутствии продукта ), ферменты, катализирующие его синтез, не нужны, и кодирующий их оперон репрессируется .В отсутствие продукта , когда клетке нужно производить больше, индуцируется биосинтетический оперон . Например, оперон trp кодирует ферменты, которые катализируют превращение хорисминовой кислоты в триптофан. Когда клеточная концентрация Trp (или Trp-tRNAtrp) высока, оперон не экспрессируется, но когда уровни низкие, оперон экспрессируется.
Индуцибельные опероны в сравнении с подавляемыми
Индуцибельные опероны включаются в ответ на метаболит (небольшая молекула, подвергающаяся метаболизму), который регулирует оперон.Например. lac-оперон индуцируется в присутствии лактозы (под действием побочного продукта метаболизма аллолактозы). Репрессируемые опероны отключаются в ответ на небольшую регуляторную молекулу. Например, оперон trp репрессируется в присутствии триптофана. Обратите внимание, что в этом случае термины определяются ответом на небольшую молекулу. Хотя lac является индуцибельным опероном, мы увидим условия, при которых он репрессируется или индуцируется (посредством дерепрессии).
Таблица 4.1.3.
Карта оперона E. colilac
Рисунок 4.1.1.
- Промоторы = p = сайты связывания для РНК-полимеразы, с которых она инициирует транскрипцию. Существуют отдельные промоторы для генов lacI и lacZYA .
- Оператор = o = сайт связывания репрессора; перекрывается с промоутером для lacZYA .
- Репрессор , кодируемый геном lacI
- Структурные гены : lacZYA
lacZ кодирует b-галактозидазу, которая расщепляет дисхаридную лактозу на галактозу и глюкозу.
lacY кодирует пермеазу лактозы, мембранный белок, который способствует усвоению лактозы.
lacA кодирует β-галактозид трансацетилазу; функция этого фермента в катаболизме лактозы не изучена (по крайней мере, мной)
C. Отрицательный контроль
Оперон lac находится под как отрицательным, так и положительным контролем. Их механизмы будут рассмотрены отдельно.
1. В отрицательном контроле гены lacZYA выключаются репрессором, когда индуктор отсутствует (сигнализируя об отсутствии лактозы). Когда репрессорный тетрамер связан с o , lacZYA не транскрибируется и, следовательно, не экспрессируется.
Рисунок 4.1.2. Репрессированный lac оперон
2. Когда присутствует индуктор (сигнализирующий о присутствии лактозы), он связывает репрессорный белок, тем самым изменяя его конформацию, уменьшая его сродство к o , оператор. Диссоциация комплекса репрессор-индуктор позволяет транскрибировать и, следовательно, экспрессировать lacZYA .
Рисунок 4.1.3. Индукция lac-оперона путем дерепрессии.
Индукторы
Естественный индуктор (или антирепрессор) — это аллолактоза , аналог лактозы. Он образуется как побочный продукт метаболизма реакции, катализируемой β-галактозидазой. Обычно этот фермент катализирует расщепление лактозы до галактозы + глюкозы, но иногда он катализирует изомеризацию с образованием аллолактозы, в которой галакоза связана с C6 глюкозы вместо C4.
. Беспричинный индуктор будет индуцировать оперон, но не метаболизируется кодируемыми ферментами; следовательно, индукция сохраняется дольше.Одним из наиболее распространенных препаратов, используемых в лаборатории, является синтетический аналог лактозы, называемый изопропилтиогалактозидом (IPTG). В этом соединении b-галактозидная связь связана с тиолом, который не является эффективным субстратом для b-галактозидазы.
E. Регуляторные мутанты
Регуляторные мутации влияют на количество всех ферментов, кодируемых опероном, тогда как мутации в структурном гене влияют только на активность кодируемого (одиночного) полипептида.
Репрессорные мутанты
- а.Штаммы дикого типа ( lacI + ) являются индуцибельными .
- г. Большинство штаммов с дефектным репрессором ( lacI- ) являются конститутивными , то есть они вырабатывают ферменты, кодируемые lac-опероном, даже в отсутствие индуктора.
- г. Штаммы с репрессором, который не может взаимодействовать с индуктором ( lacI S ), не индуцируются . Поскольку индуктор не может связываться, репрессор остается на операторе и предотвращает экспрессию оперона даже в присутствии индуктора.
- г. Вычеты по фенотипам мутантов
| β-галактозидаза | трансацетилаза | ||||
|---|---|---|---|---|---|
| Генотип | -IPTG | + IPTG | -IPTG | + IPTG | Заключение |
| I + Z + A + | <0.1> | 100 | <1> | 100 | Индуктивный |
| I + Z-A + | <0,1> | <0,1> | <1> | 100 | lacZ кодирует b-галактозидазу |
| I-Z + A + | 100 | 100 | 90 | 90 | Учредительный |
| I + Z-A + / F ‘I-Z + A + | <0.1> | 100 | <1> | 200 | I + > I- в транс |
| IsZ + A + | <0,1> | <1> | <1> | <1> | Не индуцируемый |
| IsZ + A + / F ‘I + Z + A + | <0.1> | 1 | <1> | 1 | Это >. I + в транс |
- Оперон дикого типа индуцируется IPTG.
- Мутация lacZ затрагивает только b-галактозидазу, но не трансацетилазу (или другие продукты оперона), показывая, что lacZ является структурным геном.
- Мутация lacI влияет на оба фермента, следовательно, lacI является регуляторным геном.Оба экспрессируются в отсутствие индуктора, следовательно, оперон экспрессируется конститутивно (штамм демонстрирует конститутивный фенотип).
- В меродиплоидном штамме, в котором одна копия lac-оперона находится на хромосоме, а другая копия — на F ‘-факторе, можно проверить доминирование одного аллеля над другим. Дикий тип lacI + является доминирует над lacI- в транс . В ситуации, когда единственный функциональный ген lacZ находится на той же хромосоме, что и lacI- , функциональный ген lacI все еще вызывает репрессию в отсутствие индуктора.
- Аллель lacI S не индуцируется.
- В меродиплоиде аллель lacI S аллель доминирует над диким типом в tran s .
эл.Тот факт, что продукт гена lacI действует на trans , означает, что это диффундирующая молекула, которая может кодироваться на одной хромосоме, но действовать на другую, такую как хромосома F ‘в примере (d) выше. Фактически продукт гена lacI является белком-репрессором.
2. Оператор-мутанты
а. Дефекты в операторе приводят к конститутивной экспрессии оперона, поэтому можно выделить конститутивных мутаций оператора , сокращенно o c . o + дикого типа индуцибельны.
г. Мутации в операторе: cis, — действие; они влияют только на экспрессию структурных генов на одной и той же хромосоме.
(1) Меродиплоид I + o c Z + / I + o + Z — [это сокращение от lacI + o c lacZ + / lacI + o + lacZ — ] экспрессирует β-галактозидазу конститутивно.Таким образом, o c доминирует над o + , когда o c находится в cis до lacZ + .
(2) Меродиплоид I + o c Z — / I + o + Z + индуцируется для экспрессии β-галактозидазы . Таким образом, o + доминирует над o c , когда o + находится в cis до lacZ + .
(3) Аллель o , который находится в cis активного репортерного гена (т.е. на той же хромосоме, что и lacZ + в данном случае), является тем, фенотип которого виден. Таким образом, действует оператор цис-, и это свойство упоминается как доминирование цис-. Как и в большинстве случаев регуляторных последовательностей цис , эти участки ДНК необходимы для регуляции. В этом случае оператор является сайтом связывания для репрессорного белка, действующего на trans, .
Взаимодействие между оператором и репрессором
Последовательность действий оператора
Оператор перекрывает стартовый сайт транскрипции и промотор. Он имеет симметрию диады с центром в +11. Такая диадная симметрия обычно обнаруживается в сайтах связывания для симметричных белков (репрессор — гомотетрамер). Последовательность ДНК, из которой состоит оператор, определялась положением мутаций o C , а также нуклеотидов, защищенных от реакции с, например.г. ДМС, при связывании репрессора.
Рисунок 4.1.4.
2. Репрессор
а. Очищение
(1) Увеличьте количество репрессора в исходном материале на сверхэкспрессии.
Клетка дикого типа имеет всего около 10 молекул репрессорного тетрамера. Выделению и очистке белка в значительной степени способствовало использование мутантного штамма с мутациями ап-промотора для lacI , так что в каждой клетке присутствовало намного больше копий белка.Эта общая стратегия избыточного производства белка широко используется в схемах очистки. Теперь ген этого белка клонируется в векторе экспрессии, так что хозяин (в данном случае бактерии) производит большое количество белка — часто значительную долю от общего бактериального белка.
(2) Анализы на репрессор
[1] Связывание меченного радиоактивным изотопом IPTG (безвозмездный индуктор) с репрессором
[2] Связывание радиоактивно меченной последовательности операторной ДНК с репрессором. Это можно контролировать по способности комплекса белок-ДНК связываться с нитроцеллюлозой (тогда как меченный радиоактивным изотопом мутантный фрагмент ДНК оператора, o c , плюс репрессор не будут связываться).Анализы сдвига электрофоретической подвижности теперь будут использоваться во многих случаях.
[3] Эта способность конкретных последовательностей связываться с высоким сродством с желаемым белком часто используется для быстрого выделения белка. Сайт связывания можно синтезировать в виде дуплексных олигонуклеотидов. Они сшиваются вместе с образованием мультимеров, которые затем прикрепляются к твердой подложке в колонке. Затем желаемый ДНК-связывающий белок может быть выделен с помощью аффинной хроматографии , используя сайт связывания в ДНК в качестве аффинного лиганда.
г. Изолированный функциональный репрессор представляет собой тетрамер ; каждый из четырех мономеров является продуктом гена lacI (т.е. является гомотетрамером).
г. ДНК-связывающий домен репрессора lac укладывается в домен спираль-поворот-спираль . Мы рассмотрим эту структурную область более подробно в главе III. Это один из наиболее распространенных ДНК-связывающих доменов у прокариот, и аналогичный структурный домен (гомеодомен) обнаружен в некоторых регуляторах транскрипции эукариот.
3. Пункты связи между репрессором и оператором
а. При исследовании точек контакта между репрессором и оператором использовались те же методы, которые мы обсуждали ранее для картирования сайта связывания РНК-полимеразы на промоторе, например Анализы сдвига электрофоретической подвижности (связывается ли фрагмент ДНК?), следы ДНКазы (где связывается белок?) и анализы интерференции метилирования (метилирование каких пуринов предотвращает связывание?).Альтернативные схемы позволят идентифицировать сайты, в которых метилирование либо предотвращается, либо усиливается связыванием репрессора. Эти методы обеспечивают биохимическое определение оператора = сайта связывания репрессора.
г. Ключевые точки контакта (см. Рисунок 4.1.4.):
(1) находятся в симметрии диады.
(2) совпадают (во многих случаях) с нуклеотидами, которые при мутации приводят к конститутивной экспрессии. Обратите внимание, что последний является генетическим определением оператора и совпадает с биохимически определенным оператором.
(3) имеют тенденцию симметрично распределяться вокруг оси диады (+11).
(4) в основном находятся на одной стороне двойной спирали ДНК.
г. Частичное перекрытие между оператором и промотором первоначально предложило модель стерического вмешательства для объяснения механизма репрессии. Пока репрессор был связан с оператором, полимераза не могла связываться с промотором. Но, как будет показано в следующей главе, это , а не . РНК-полимераза может связываться с промотором lac , даже если репрессор связан с оператором lac .Однако полимераза не может инициировать транскрипцию при наложении на репрессор.
4. Конформационный сдвиг репрессора при связывании индуктора
а. Репрессор имеет два разных домена: один, который связывается с ДНК («головной убор», содержащий домен спираль-поворот-спираль), а другой, который связывается с индуктором (и другими субъединицами) (называемый «ядром»). петля «обл.
г. Эти структурные домены можно различить по фенотипам мутаций, которые в них происходят.
lacI -d предотвращает связывание с ДНК, приводит к конститутивной экспрессии.
lacI S предотвращает связывание индуктора, приводит к неиндуцибельному фенотипу.
г. Связывание индуктора с «ядром» вызывает аллостерический сдвиг в репрессоре, так что «головной убор» больше не может образовывать высокоаффинный комплекс с ДНК, и репрессор может диссоциировать (перейти к одному из многих конкурирующих неспецифических сайтов ).
Положительный контроль: «катаболитная репрессия»
1. Катаболит репрессия
а. Даже бактерии могут быть разборчивы в том, что они едят. Глюкоза является предпочтительным источником углерода для E. coli ; бактерия будет потреблять доступную глюкозу перед использованием альтернативных источников углерода, таких как лактоза или аминокислоты.
г. Глюкоза приводит к подавлению экспрессии lac и некоторых других катаболических оперонов. Это явление называется катаболитной репрессией .
2. Два компонента необходимы для этой формы регламента
а. цАМП
[1] В присутствии глюкозы [цАМФ] внутри клетки уменьшается с 10-4 М до 10-7 М. Высокий [цАМФ] снимает репрессию катаболита.
[2] Синтез цАМФ катализируется аденилатциклазой (продукт гена cya )
ATP ® cAMP + PP i
г. Белок-активатор катаболита = CAP
[1] Продукт гена cap , также называемый crp (белок рецептора цАМФ).
[2] Является димером
[3] Связывает цАМФ, а затем комплекс цАМФ-ЦАП связывается с ДНК в определенных сайтах
3. Сайт связывания для cAMP-CAP
а. В lac-опероне сайт связывания представляет собой область размером около 20 п.н., расположенную прямо перед промотором, от -52 до -72.
г. Пентамер TGTGA является важным элементом распознавания. Для lac-оперона сайт связывания представляет собой диаду с этой последовательностью по обе стороны диады.
г.Точки контакта между цАМФ-ЦАП и ДНК близки или совпадают с мутациями, которые делают промотор lac более не чувствительным к цАМФ-ЦАП.
г. cAMP-CAP связывается на одной стороне спирали.
Рисунок 4.1.5. Сайт связывания для cAMP-CAP
4. Связывание цАМФ-CAP с его сайтом повысит эффективность инициации транскрипции на промоторе
а. Промотор lac не является особенно сильным промотором.Последовательность -10, TATGTT, не соответствует консенсусу (TATAAT) в двух положениях.
г. В присутствии цАМФ-CAP РНК-полимераза будет более эффективно инициировать транскрипцию.
г. Промотор lac UV5 представляет собой мутацию повышающего промотора, в которой область -10 соответствует консенсусу. Lac-оперон, управляемый промотором UV5, будет достигать высокого уровня индукции без цАМФ-CAP, но промотор дикого типа требует цАМФ-CAP для индукции высокого уровня.
Рисунок 4.1.6. Регуляторная область lac-оперона, включая сайт связывания CAP
5. Механизм действия cAMP-CAP
а. Прямое положительное взаимодействие с РНК-полимеразой . С-конец α-субъединицы необходим для активации РНК-полимеразы с помощью цАМФ-CAP. Более подробно это будет рассмотрено в Главе 16.
г. cAMP-CAP изгибает ДНК примерно 90 o.
Рисунок 4.1.7. ДНК (верхняя спиральная структура) изгибается димером CAP.
Некоторые общие сведения
- Репрессоры, активаторы и полимеразы взаимодействуют в первую очередь с одной стороной двойной спирали ДНК.

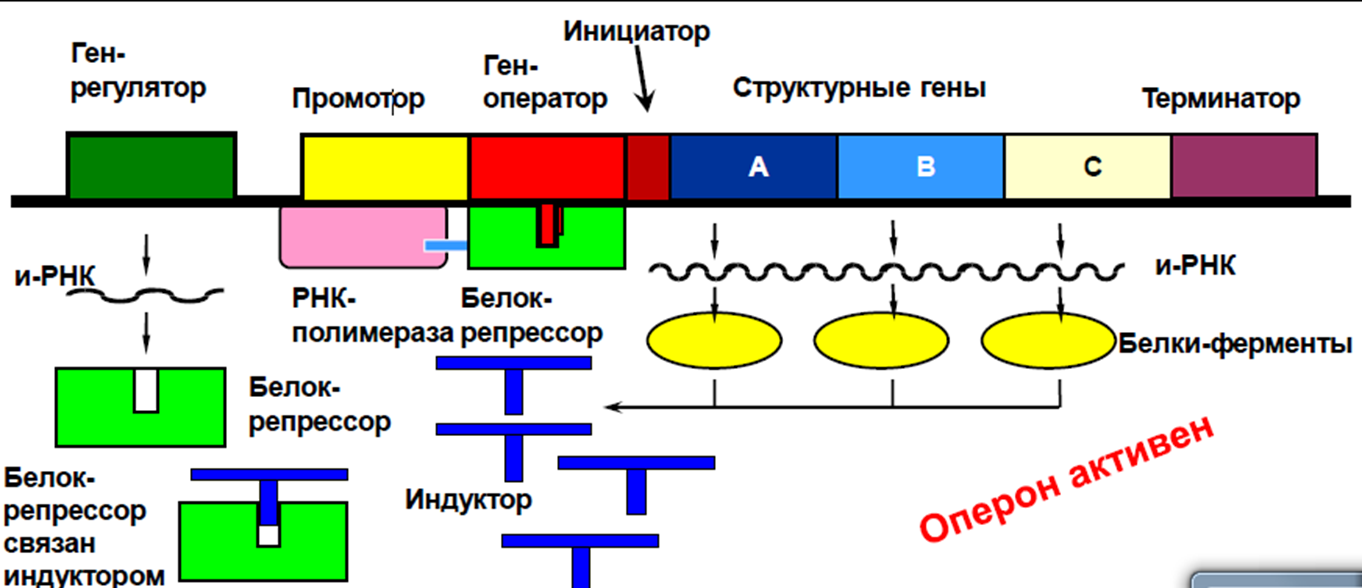 Данная система является универсальной для решения различных классов задач, однако, она достаточно критична к численности популяции, т.е. эффективность алгоритма, использующего такой подход, снижается с увеличением числа особей.
Данная система является универсальной для решения различных классов задач, однако, она достаточно критична к численности популяции, т.е. эффективность алгоритма, использующего такой подход, снижается с увеличением числа особей.