Цена расшифровка генома человека: Стоимость расшифровки генома человека упала до 4,4 тысячи долларов: Наука и техника: Lenta.ru
Содержание
Стоимость расшифровки генома человека упала до 4,4 тысячи долларов: Наука и техника: Lenta.ru
Американская биотехнологическая компания Complete Genomics объявила, что созданная ею технология позволит расшифровать последовательность генома человека всего за 4,4 тысячи долларов. Ранее та же компания называла цифру 5 тысяч долларов. Основной принцип нового метода описан на портале ScienceNOW.
Геном человека содержит около 3 миллиардов «букв» — нуклеотидов. С учетом того, что каждая хромосома представлена в двух копиях, общее число нуклеотидов составляет 6 миллиардов. Расшифровка последовательности ДНК человека позволит исследователям узнать множество индивидуальных особенностей, в том числе, предрасположенность к тем или иным заболеваниям.
Впервые геном Homo sapiens был расшифрован в 2001 году в рамках проекта «Геном человека». Этот процесс занял несколько лет, и в нем приняли участие сотни ученых по всему миру. Общая стоимость расшифровки составила около 3 миллиардов долларов. Постепенно технологии определения последовательности ДНК, или секвенирования, совершенствовались. При этом скорость работ росла, а их стоимость падала.
Постепенно технологии определения последовательности ДНК, или секвенирования, совершенствовались. При этом скорость работ росла, а их стоимость падала.
Метод, разработанный Complete Genomics, использует «классическую» методику секвенирования ДНК, известную как метод Сэнгера. Коротко суть метода можно описать следующим образом: на первой стадии геном разрезается на множество коротких фрагментов длиной в несколько десятков нуклеотидов. Далее определяются последовательности этих кусочков. Затем полученные кусочки сопоставляются друг с другом, и из них при помощи компьютера выстраивается полногеномная последовательность.
По утверждениям специалистов Complete Genomics, новая технология позволит им в ближайшем будущем секвенировать геном одного человека в течение дня. Столь высокая скорость делает метод пригодным для широкого практического применения. Однако анонсирование нового метода вызвало критическую реакцию в научном сообществе. Скептицизм ученых вызвала низкая точность технологии — приблизительно одна ошибка на 100 тысяч оснований. Соответственно, на 3 миллиарда «букв» накопится 30 тысяч ошибок. При том, что многие наследственные заболевания вызываются заменой единичных нуклеотидов, «грубость» новой технологии может свести на нет все ее достоинства.
Соответственно, на 3 миллиарда «букв» накопится 30 тысяч ошибок. При том, что многие наследственные заболевания вызываются заменой единичных нуклеотидов, «грубость» новой технологии может свести на нет все ее достоинства.
Для стимуляции исследователей, работающих над поиском новых дешевых и быстрых методов секвенирования ДНК, фонд X-Prize, созданный для поддержки «безумных» научных проектов, объявил о премии в десять миллионов долларов. Приз достанется тому коллективу ученых, который сможет секвенировать сто геномов человека в течение не более чем десяти дней при стоимости не выше десяти тысяч долларов за геном.
Завершился семилетний проект по расшифровке генома человека
Ключ к лечению рака, несвертываемости крови, болезни Альцгеймера и многих других заболеваний был получен в ходе масштабного семилетнего проекта по расшифровке генома человека, который завершился в ночь на четверг. В итоге генетики полностью расшифровали геномы более чем 2,5 тыс. человек, каждый из которых состоит из 3 млрд генов. О своей работе и планах ученые рассказали отделу науки «Газеты.Ru».
О своей работе и планах ученые рассказали отделу науки «Газеты.Ru».
1000 Genomes Project — масштабный проект, запущенный в январе 2008 года, изначальной целью которого было полное секвенирование (расшифровка) геномов тысячи человек — представителей разных рас и национальностей. В работе приняли участие команды исследователей из США, Великобритании, Италии, Перу, Кении, Нигерии, Китая и Японии. Расшифровка полного генома человека — задача непростая, так как
он содержит 20–25 тыс. активных генов. Впрочем, это составляет очень незначительную часть всех генов — остальные относятся к так называемой «мусорной ДНК», то есть не кодируют никаких белков. Но с учетом «мусорной ДНК» объем генома человека достигает около 3 млрд пар нуклеотидов.
Но с учетом «мусорной ДНК» объем генома человека достигает около 3 млрд пар нуклеотидов.
Масштабная работа, проделанная учеными, имеет непосредственное отношение ко всем живущим на планете людям. В ходе работы ученым удалось расшифровать геномы 2504 человек, представляющих 26 разных популяций. Исследователям удалось установить, какие именно вариации имеет каждый человеческий ген — а это может помочь в том, чтобы понять, за какое генетическое заболевание он отвечает. Ученым уже удалось понять,
какие именно генетические вариации ответственны за возникновение заболеваний сердечной мышцы (миокарда), хронических воспалений желудочно-кишечного тракта, серповидноклеточной анемии (нарушений строения гемоглобина) или болезни Гоше — наследственного заболевания, которое приводит к накоплению сложных жиров во многих тканях, включая селезенку, печень, почки, легкие, головной мозг и костный мозг.
Данные, полученные в результате работы, доступны на сайте самого проекта. В ночь со вторника на среду в журнале Nature вышли две статьи, представляющие последние обзорные данные, которые были получены в ходе работы. Корреспонденту отдела науки «Газеты.Ru» удалось пообщаться с тремя учеными, которые принимали непосредственное участие в расшифровке генома человека: Полом Фличеком (одним из ведущих исследователей 1000 Genomes Project и ведущим научным сотрудником Европейской молекулярно-физической лаборатории), Гонсало Абекасисом (профессором Мичиганского университета) и Адамом Отоном (Нью-йоркский медицинский колледж им. Альберта Эйнштейна) и поговорить с ними о дальнейших планах и возможности практического применения результатов семилетней работы.
Корреспонденту отдела науки «Газеты.Ru» удалось пообщаться с тремя учеными, которые принимали непосредственное участие в расшифровке генома человека: Полом Фличеком (одним из ведущих исследователей 1000 Genomes Project и ведущим научным сотрудником Европейской молекулярно-физической лаборатории), Гонсало Абекасисом (профессором Мичиганского университета) и Адамом Отоном (Нью-йоркский медицинский колледж им. Альберта Эйнштейна) и поговорить с ними о дальнейших планах и возможности практического применения результатов семилетней работы.
— В 2008 году, когда проект только начинался, перед учеными была поставлена цель: расшифровать полный геном тысячи человек. В октябре 2012 года журнал Nature объявил о том, что окончена расшифровка 1092 геномов. На текущий момент — к окончанию проекта — вам удалось секвенировать 2504 генома. Скажите, как вам удалось так существенно перевыполнить план?
Пол Фличек: Нам удалось секвенировать так много образцов, потому что за последние годы технологии, позволяющие осуществлять секвенирование генома, получили существенное развитие. Именно поэтому нам удалось получить примерно в 25 раз больше данных, чем было заявлено изначально.
Именно поэтому нам удалось получить примерно в 25 раз больше данных, чем было заявлено изначально.
Гонсало Абекасис: Не стоит забывать и о стоимости подобного анализа. Если в 2008 году полная расшифровка генома человека стоила около $100 тыс., то теперь эта сумма составляет менее $2 тыс.
— 30 сентября было объявлено о том, что финальная стадия проекта завершена. Можно ли говорить о полном завершении работ или же вы собираетесь идти дальше и ставить перед собой новые цели?
Пол Фличек: Перед нами стоит множество новых целей, касающихся как секвенирования ДНК, так и поиска взаимосвязей между вариациями разных генов, возникновения генетических заболеваний и других характеристик человека. Завершение 1000 Genomes Project — это действительно кульминация усилий, которые мы начали предпринимать еще 15 лет назад и целью которых было создание открытого ресурса, содержащего информацию о человеческих генах.
В будущем мы планируем расширить базу наших исследований и привлечь к нему людей, представляющих большее число популяций из разных стран мира, — в Африке, Азии и на Среднем Востоке остаются популяции, не вовлеченные в исследование. Теперь эта работа будет проводиться в рамках проекта International Genome Sample Resource.
Теперь эта работа будет проводиться в рамках проекта International Genome Sample Resource.
Гонсало Абекасис: Кроме того, в дальнейшем мы планируем фокусироваться на том, как вариации каждого гена влияют на течение конкретной болезни. Для этого нужно изучить как можно большее число случаев течения и лечения подобных заболеваний.
Адам Отон: А еще мы собираемся проверить, как генетические вариации влияют на фенотип человека.
— А можно ли применять полученную вами информацию на практике уже сейчас? Или все-таки еще требуется дополнительное время на обработку данных?
Гонсало Абекасис: Собранная нами информация полезна для исследователей уже сейчас — она помогает ученым понять, сколько вариаций имеет каждый ген, какие из этих вариаций несут ответственность за возникновение разных заболеваний. Правда, до того момента, когда эти знания приведут к разработке новых лекарств, еще пройдет определенное время.
Правда, до того момента, когда эти знания приведут к разработке новых лекарств, еще пройдет определенное время.
Адам Отон: Информация активно используется, и не только врачами, а вообще всеми желающими. Если исследователь — из любой сферы — хочет узнать, какие функции выполняет какой-либо ген, как он распространен среди населения земного шара или как выглядит какой-то участок генома, он может с легкостью получить эту информацию.
Пол Фличек: Я считаю, основная практическая польза полученных нами данных — это то, что они помогают составить карту распространения какого-то гена на планете.
Допустим, у человека родом из Азии обнаружили редкое генетическое заболевание. Но данные нашего проекта говорят, что вариация какого-то гена (вызывающего это заболевание) есть только в ДНК африканцев. Это будет означать, что корни заболевания надо искать в изменениях другого гена. Кроме того, мы стали лучше понимать, как разные популяции людей мигрировали по миру.
— Если бы вас попросили описать результаты семилетней работы в одном-двух предложениях, что бы вы сказали?
Пол Фличек: Важнейший результат 1000 Genomes Рroject — это составление каталога вариаций человеческих генов и анализ методов и инструментов, которые могут быть использованы для дальнейшего секвенирования генома человека. Этот каталог полностью бесплатен и находится в открытом доступе.
Этот каталог полностью бесплатен и находится в открытом доступе.
Гонсало Абекасис: Теперь у нас есть каталог, где представлены разные версии каждой последовательности ДНК, а значит, каждого гена, и с помощью которого мы можем определить, в каких регионах планеты распространена каждая версия. Мы можем использовать эту информацию, чтобы сократить время и затраты, необходимые на расшифровку генома других людей.
Адам Отон: 1000 Genomes Project самым существенным образом улучшил наше понимание того, как вариации человеческих генов распространены в мире.
— И последний вопрос: что вы чувствуете сейчас, когда семилетний проект, в котором вы принимали самое непосредственное участие, завершен?
Гонсало Абекасис: Я чувствую, что пришло время принять следующий вызов: применить то, что мы узнали, на практике и начать разрабатывать методы лечения генетических заболеваний.
Адам Оттон: Проект стал базой для дальнейшей работы: все хотят знать, что вариации генов могут рассказать нам о различных заболеваниях. Несколько следующих лет обещают быть очень насыщенными.
Несколько следующих лет обещают быть очень насыщенными.
Пол Фличек: Мне немного грустно. Наш проект был яркой демонстрацией того, на что способны современные технологии. Проект постоянно рос и развивался — вместе с развитием технологий, а его завершение действительно означает конец целой эпохи. Хотя, само собой, использование данных, полученных при расшифровке ДНК, еще только начинается, и мне кажется, что 1000 Genomes Project можно сравнить с ребенком, которому еще расти и расти.
Ученые сообщили о новом успехе в расшифровке полного генома человека
https://ria.ru/20200729/1575126574.html
Ученые сообщили о новом успехе в расшифровке полного генома человека
Ученые сообщили о новом успехе в расшифровке полного генома человека — РИА Новости, 29.07.2020
Ученые сообщили о новом успехе в расшифровке полного генома человека
Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению. .. РИА Новости, 29.07.2020
.. РИА Новости, 29.07.2020
2020-07-29T18:12
2020-07-29T18:12
2020-07-29T19:32
наука
геном
биология
здоровье
открытия — риа наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn21.img.ria.ru/images/07e4/07/1d/1575122181_0:0:1920:1080_1920x0_80_0_0_c09c7518bc67a63c3f0312916aab08a7.jpg
МОСКВА, 29 июл — РИА Новости. Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению энциклопедии функциональных элементов ДНК. В 14 статьях, опубликованных в журналах Nature, Nature Methods и Nature Communications, авторы подводят итоги 17-летней работы.Геном человека содержит около 20 тысяч генов, кодирующих белки, на долю которых приходится всего около 1,5 процентов ДНК генома человека.Международный исследовательский консорциум ENCODE, созданный в 2003 году и задуманный как продолжение проекта «Геном человека», ставит целью составление всеобъемлющего каталога функциональных элементов генома человека и мыши, включая кодирующие белки гены, некодирующие гены и регуляторные элементы. Все результаты, получаемые в ходе реализации проекта, публикуются в открытых базах данных. Тысячи исследователей во всем мире уже воспользовались данными ENCODE для определения генетических изменений, влияющих на появление таких болезней, как рак, сердечно-сосудистые заболевания и многие другие.»Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».В ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши.
Все результаты, получаемые в ходе реализации проекта, публикуются в открытых базах данных. Тысячи исследователей во всем мире уже воспользовались данными ENCODE для определения генетических изменений, влияющих на появление таких болезней, как рак, сердечно-сосудистые заболевания и многие другие.»Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».В ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши. Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов. Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов.Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.»Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека.
Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов. Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов.Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.»Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека. Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.»Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы.На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.»Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы.На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
https://ria.ru/20200714/1574331963.html
https://ria.ru/20200319/1568838103.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og. xn--p1ai/
xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn24.img.ria.ru/images/07e4/07/1d/1575122181_238:0:1678:1080_1920x0_80_0_0_b1197b2345cad8e15168ec4a60bfc499.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
геном, биология, здоровье, открытия — риа наука
МОСКВА, 29 июл — РИА Новости. Международный консорциум ENCODE, состоящий из 500 ученых-биологов из многих стран мира сообщил о завершении третьего этапа глобального проекта по составлению энциклопедии функциональных элементов ДНК. В 14 статьях, опубликованных в журналах Nature, Nature Methods и Nature Communications, авторы подводят итоги 17-летней работы.
Геном человека содержит около 20 тысяч генов, кодирующих белки, на долю которых приходится всего около 1,5 процентов ДНК генома человека.
Международный исследовательский консорциум ENCODE, созданный в 2003 году и задуманный как продолжение проекта «Геном человека», ставит целью составление всеобъемлющего каталога функциональных элементов генома человека и мыши, включая кодирующие белки гены, некодирующие гены и регуляторные элементы.
Все результаты, получаемые в ходе реализации проекта, публикуются в открытых базах данных. Тысячи исследователей во всем мире уже воспользовались данными ENCODE для определения генетических изменений, влияющих на появление таких болезней, как рак, сердечно-сосудистые заболевания и многие другие.
«Когда был завершен первый набросок генома человека, сразу стало ясно, что первичная последовательность генома — это черновик, — приводятся в пресс-релизе Лаборатории в Колд-Спринг-Харбор слова одного из участников консорциума, профессора лаборатории Томаса Джингераса (Thomas Gingeras). — Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».
— Мы знали, где находятся гены, но знаний о том, где расположены регуляторные механизмы и локусы, было недостаточно».
14 июля 2020, 18:00НаукаГенетики расшифровали полную последовательность Х-хромосомы человека
В ходе третьей фазы проекта исследователи провели почти шесть тысяч новых экспериментов — 4834 с участием человеческих образцов и 1158 — на мышах — и добавили в онлайн-реестр более 1 200 000 функциональных элементов — областей некодирующей ДНК, которые регулируют транскрипцию генов, охватывающих 7,9 процента человеческого генома и 3,4 процента генома мыши.
Часть исследований посвящена изучению принципов, регулирующих работу некоторых из этих функциональных элементов.
Например, Майкл Снайдер (Michael Snyder) из Медицинской школы Стенфордского университета в США и его коллеги исследовали взаимодействие хроматина — комплекса ДНК и белков — в 24 типах клеток человека и обнаружили, что различия в цикличности хроматина между типами клеток могут влиять на экспрессию генов.
Команда Томаса Джингераса изучила элементы генома, которые инструктируют клетки о том, как и когда транскрибировать последовательности ДНК в РНК. Ученым удалось идентифицировать и описать молекулярные признаки пяти групп клеток человека.
«Наша работа определяет, основываясь на экспрессии генов, основные гистологические типы, по которым традиционно классифицируются ткани человека», — говорит Родерик Гиго (Roderic Guigó) из Центра геномного регулирования, один из авторов исследования.
Участники консорциума отмечают, что элементы, управляющие функционированием генов, целиком кодируются в геноме человека и знания об их организации могут послужить отправной точкой для изучения нарушений развития человека. Однако, несмотря на очевидный прогресс, многие элементы, которые влияют на конкретные типы или состояния генов, еще предстоит идентифицировать.
«Эта энциклопедия является живым ресурсом. У нее есть начало, но на самом деле нет конца. Со временем она будет только совершенствоваться и расти», — пишут во вступительной статье авторы.
На четвертом этапе исследования участники проекта ENCODE планируют сосредоточить усилия на новых типах анализируемых клеток и тканей.
19 марта 2020, 13:30Распространение коронавирусаРоссийские ученые расшифровали полный геном коронавируса
Расшифровка генома лиственницы генетиками СФУ стала результатом мирового значения
Группа исследователей лаборатории лесной геномики научно-образовательного центра геномных исследований Сибирского федерального университета провела секвенирование, сборку и аннотацию ядерного, митохондриального и хлоропластного геномов сибирской лиственницы — одного из важнейших представителей бореальных хвойных лесов, имеющего важное экономическое и экологическое значение.
Это крупный результат красноярских учёных, достигнутый в рамках мегагранта «Геномные исследования основных бореальных лесообразующих хвойных видов и их наиболее опасных патогенов в Российской Федерации». Ядерные геномы хвойных имеют громадный размер, в 4–9 раз превыщающий геном человека и состоящий на 70–80 % из высокоповторяющихся элементов. Это в значительной степени затрудняет их анализ, и в мире существуют только две команды учёных, сумевших расшифровать геном хвойного дерева.
Это в значительной степени затрудняет их анализ, и в мире существуют только две команды учёных, сумевших расшифровать геном хвойного дерева.
Секвенирование полных геномов важных биологических видов, для которых ещё не опубликован референсный (эталонный) геном, несмотря на быстрое развитие технологий и их большую доступность, остаётся очень дорогостоящим и трудоёмким. Для проведения таких исследований требуется новейшее специализированное оборудование и реактивы для него, специалисты высокой квалификации как для работы непосредственно с биологическим материалом (лабораторный этап), так и для обработки огромного объёма данных (биоинформатический этап). Проведение подобных исследований для геномов сибирских хвойных стало возможным благодаря полученному в 2014 году мегагранту.
«Сборка геномов хвойных деревьев является сложной задачей, требующей в каждом отдельном случае специально разработанных подходов, как при постановке эксперимента, так и при проведении вычислений., — сообщил заведующий кафедрой высокопроизводительных вычислений ИКИТ, канд. техн. наук Дмитрий Кузьмин, первый автор статьи.Геном лиственницы состоит из 12 млрд нуклеотидных оснований, что в 4 раза больше генома человека. Большой объём генома и, как следствие, большой объём входных данных, требуемый для получения качественной сборки, становится проблемой для большинства современных программ сборщиков генома (ассемблеров). Нам удалось разработать и реализовать уникальную методику поэтапной сборки генома „по частям“, которая позволяет обойти ограничения современных ассемблеров и получить надёжную сборку генома сибирской лиственницы, соответствующую исходному биологическому материалу. Наша методика позволяет осуществлять относительно быструю сборку очень больших геномов на сравнительно небольших объёмах вычислительных ресурсов»
Другой важный результат — расшифровка хлоропластного генома лиственницы сибирской, его сравнение с хлоропластными геномами других хвойных и обнаружение однонуклеотидных полиморфизмов. Ранее результаты этого исследования опубликованы в статье «Siberian larch (Larix sibirica Ledeb.) chloroplast genome and development of polymorphic chloroplast markers».
Ранее результаты этого исследования опубликованы в статье «Siberian larch (Larix sibirica Ledeb.) chloroplast genome and development of polymorphic chloroplast markers».
«Полные эталонные хлоропластные геномы, подобные описанному и изученному нашим коллективом, могут помочь в повторном секвенировании геномов хлоропластов и поиске дополнительных генетических маркеров с использованием выборок популяции. Результаты этого исследования будут полезны для дальнейших филогенетических и генетических исследований хвойных деревьев», — отметила соавтор статьи научный сотрудник лаборатории лесной геномики СФУ Юлия Путинцева.
«Короткие прочтения генома лиственницы сибирской были получены с помощью прибора-секвенатора Illumina HiSeq2000. Проведено 7 запусков секвенатора, каждый из которых длился 11 дней. Для поиска белок-кодирующих последовательностей также были секвенированы транскриптомы разных тканей лиственницы сибирской.— рассказывает старший научный сотрудник лаборатории лесной геномики СФУ, кандидат биологических наук Наталья Орешкова.Для проведения данных исследований потребовалось проведение большой подготовительной работы, начиная с обучения специалистов на мастер-классах и стажировках, закупки реактивов, заканчивая обеспечением секвенатора бесперебойной поставкой электроэнергии»
«Полученная сборка генома закладывает основу для проведения многих исследований. Её можно использовать для разработки панелей информативных маркеров и создания популяционных баз данных лесных генетических ресурсов для использования в лесном хозяйстве, например, можно контролировать посевной материал для восстановления лесов и использовать те деревья, которые оптимальны для конкретных экологических условий. Геномные данные нужны также для отбора деревьев перспективных для различных лесохозяйственных нужд или селекционной работы, а также для перехода от традиционной селекции к геномной селекции., — сообщил Константин Крутовский, руководитель лаборатории лесной геномики и НОЦ геномных исследований Сибирского федерального университета, ведущий научный сотрудник Института общей генетики им. Н. И. Вавилова Российской академии наук, профессор Гёттингенского университета (Германия) и Техасского А&М университета (США).Такие базы нужны и для идентификации происхождения растительного материала в борьбе с нелегальными рубками и нелегальным оборотом древесины. Помимо прикладных задач в процессе полногеномных исследований также решаются и научные задачи фундаментального характера. Новые знания о геномах хвойных являются фундаментом для последующих исследований эволюционных, биохимических и физиологических процессов в этих организмах. Глубокие знания о структуре генома: экзон-интронной структуре генов, повторяющихся последовательностей и межгенных регуляторных участков позволят понять генетические механизмы регуляции этих процессов, а также эволюцию геномов хвойных, древнейших представителей растительного мира»
Под его руководством осуществлялись все этапы данного исследования.
Добавим, столь крупный результат красноярским учёным удалось достигнуть благодаря правительственному мегагранту «Геномные исследования основных бореальных лесообразующих хвойных видов и их наиболее опасных патогенов в Российской Федерации». Результаты исследований опубликованы в авторитетном журнале BMC Bioinformatics в статье «Stepwise large genome assembly approach: a case of Siberian larch (Larix sibirica Ledeb)». Статья открывает цикл материалов, посвящённых полногеномным исследованиям основных российских хвойных видов.
Пятнадцать лет открытию Генома человека
«Геном человека» спустя тридцать лет с запуска международной научной программы
В 1988 году в СССР была официально запущена государственная научно-техническая программа «Геном человека» Постановлением Совета Министров СССР «О мерах по ускорению работ в области генома человека» №1060. С инициативой секвенирования генома человека выступил академик Баев А.А. — ученый в области генной инженерии.
С инициативой секвенирования генома человека выступил академик Баев А.А. — ученый в области генной инженерии.
Мы были не единственными, кто в этот период озадачился проблемами генетики. Программа «Геном человека» стала международной и одновременно самой масштабной и грандиозной за всю многовековую историю науки!
Как все начиналось
В 1988 г. в США два ученых-генетика Уильям Гилберт и Джеймс Уотсон выступили с идеей о проведении научной программы «Геном человека». Основной целью программы была расшифровка генома человека, а также других видов: бактерий, дрожжей, мышей. Планировалось, что открытие генома человека станет ключом к пониманию многих процессов эволюции, позволит изучить множество генетических заболеваний, а также разработать эффективные медицинские препараты. Неожиданно, идею поддержали Министерство энергетики США и Национальный институт здоровья США, которые согласились спонсировать программу. Стоимость ее изначально планировалась в 3 млрд. долларов США.
долларов США.
Во многом удалось получить такую высокую поддержку благодаря статусу Джеймса Уотсона, который еще в 1962 г. получил Нобелевскую премию за открытие двойной спирали ДНК, после чего им была построена одна из лучших биологических лабораторий мира «Cold Spring Harbor», существующая и по сей день.
В последующие годы к программе присоединились другие страны: Великобритания, Франция, Германия, Италия и другие страны (всего 23 государства, геном человека состоит из 23 пар хромосом). Стоит отметить, что и СССР не поскупился на финансирование развития генетики. Уже в первый год на программу «Геном человека» было выделено 20 млн. долларов США для реконструкции лабораторий, разработки нового оборудования и создания внутренней информационной базы. Каждой стране была выделена своя хромосома для исследования, работа велась полным ходом.
Первые результаты
Нельзя не отметить, что тяжелая политическая и экономическая обстановка в России 90-х годов негативно сказались и на развитии науки. В программу «Геном человека» стали выделять все меньше финансов, поэтому участие России в международной программе почти было сведено на нет. При этом, большой вклад в развитие генетики внесли ученые Института Цитологии и Генетики СО РАН (Новосибирск, Академгородок). Под руководством профессора Колчанова Н.А. было создано несколько компьютерных программ для поиска регуляторных участков генома.
В программу «Геном человека» стали выделять все меньше финансов, поэтому участие России в международной программе почти было сведено на нет. При этом, большой вклад в развитие генетики внесли ученые Института Цитологии и Генетики СО РАН (Новосибирск, Академгородок). Под руководством профессора Колчанова Н.А. было создано несколько компьютерных программ для поиска регуляторных участков генома.
При этом, правительственное финансирование в США в этот период тоже было снижено, научная работа замедлилась. По сути, программу спасла частная лаборатория «Сelera Genomics», возглавляемая биологом – Дж. Вентером. Для сравнения: программа, финансируемая правительствами государств по всему миру, могла расшифровать миллион нуклеотидных пар в год, «Сelera Genomics» расшифровывала не менее 10 млн. нуклеотидных пар в сутки. Это позволило в короткие сроки добиться значительного прогресса.
И еще важным открытием «Сelera Genomics» стал новый способ расшифровки генома, названный впоследствии – метод произвольного секвенирование путем дробления. С его помощью, в компьютерной программе можно было смоделировать полный геном, имея в физическом наличии только его фрагменты. При помощи этого способа впервые удалось узнать геном бактерии Haemophilus in-fluenzae Rd. Затем, в 1996 году этим же методом окрыли геном дрожжевой клетки, а уже 1998 удалось расшифровать геном многоклеточного организма – земляного червя Caenorhabolits elegans.
С его помощью, в компьютерной программе можно было смоделировать полный геном, имея в физическом наличии только его фрагменты. При помощи этого способа впервые удалось узнать геном бактерии Haemophilus in-fluenzae Rd. Затем, в 1996 году этим же методом окрыли геном дрожжевой клетки, а уже 1998 удалось расшифровать геном многоклеточного организма – земляного червя Caenorhabolits elegans.
Открытие генома человека
Геном человека — это совокупность генетического материала, укомплектованного в гаплоидном наборе хромосом (23 пары) в клетке организма.
В 2000 году президент США и премьер-министр Великобритании сделали амбициозное заявление о расшифровке генома человека и завершении генетической гонки. Как выяснилось позже, заявление было преждевременным, так как на тот момент геном был изучен только на 90 %. Возможно, недостоверное взыскивание представителей власти было связано с тем, что государства больше не имели возможности вкладывать огромные деньги на программу «Геном человека» или просто стремились присвоить себе лавры многолетней международной программы для поднятия политического рейтинга.
На самом деле, в окончательной версии геном человека был расшифрован в 2003 году, то есть, всего лишь 15 лет назад! При этом, некоторые пробелы в познаниях генетического кода человека остаются даже сегодня. Ученые продолжают работать над тайнами генома Homo sapiens.
Что нам дало это открытие?
Медицина. Расшифровка ДНК человека в первую очередь открыла новые грани медицины. После этого открытия, удалось научно подтвердить, что огромное количество заболеваний являются наследственными и передаются от предков к потомкам. Кроме того, понимание динамики и признаков заболевания с точки зрения молекулярной биологии позволило создать прогрессивные медицинские методы и средства. Этот процесс продолжается и сейчас, благодаря чему появляются все более эффективные способы лечения таких патологий, как онкология, сахарный диабет, болезнь Альцгеймера и многие другие.
Знание секретов молекулы ДНК дает зеленый свет развитию «персонализированной медицины», о которой ведутся разговоры уже многие годы. Термин означает применение к каждому пациенту индивидуальных способов лечения. Эпоха стандартных методов лечения уходит в прошлое. Это обусловлено тем, что теперь нам известно — генетически каждый человек уникален, природе не существует людей с одинаковым набором генов! А это означает, что не существует и универсальных медицинских средств.
Термин означает применение к каждому пациенту индивидуальных способов лечения. Эпоха стандартных методов лечения уходит в прошлое. Это обусловлено тем, что теперь нам известно — генетически каждый человек уникален, природе не существует людей с одинаковым набором генов! А это означает, что не существует и универсальных медицинских средств.
Биологам удалось выявить роль и значение многих генов в организме человека. Сегодня в обширную медицинскую практику входят ДНК-тесты, которые позволяют анализировать гены конкретного человека. Генетический тест позволяет выявить предрасположенность человека к разлитым патологиям, риски и особенности его организма. Обладая такими глубокими данными, врачи имеют возможность подобрать пациенту индивидуальную программу лечения и профилактики.
Оказалось, что гены играют огромную роль во многих аспектах жизни человека. Генетические тесты используются и в таких сферах медицины как диетология, косметология, трихология. Например, склонность к полноте, особенности метаболизма и усвоения продуктов питания тоже заложены генетически.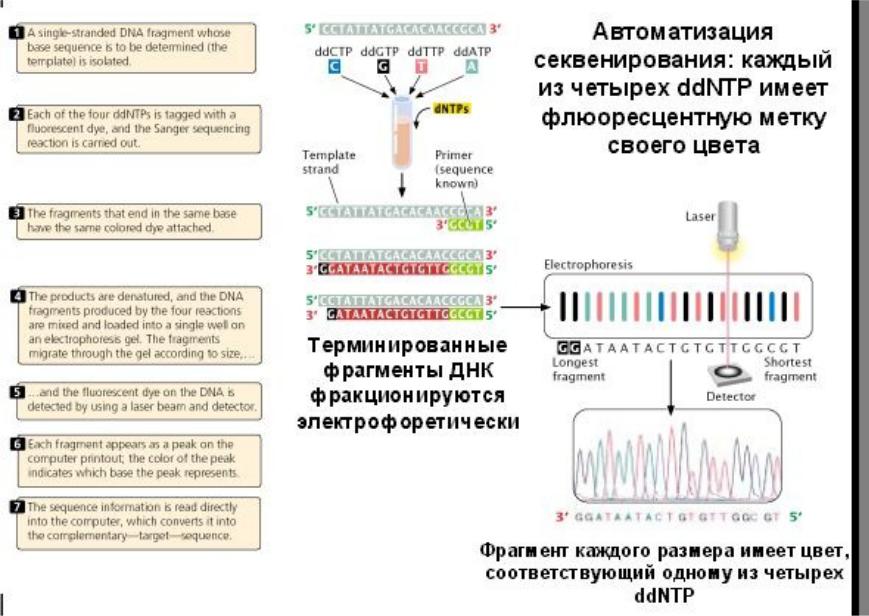 Сейчас ученые активно изучают влияние генов на характер и таланты человека.
Сейчас ученые активно изучают влияние генов на характер и таланты человека.
Криминалистика. Знание об уникальности каждого человека положило начало новой вехе в развитии криминалистики. Теперь даже один оставленный волос, капля крови, фрагмент кожи, слюна и любой биоматериал преступника может послужить для идентификации его ДНК. При чем, в надлежащих условиях хранения ДНК может храниться очень долго. Например, современные ученые изучают ДНК останков солдат, погибших во время Великой Отечественной Войны, и сравнивают их с фрагментами ДНК с фронтовых писем. Более того, проводятся даже исследования мумий египетских фараонов, пролежавших в земле более трех тысяч лет.
История. До момента расшифровки генома человека, большинство данных о прошлых цивилизациях мы получали из археологических раскопок. После открытия генома историки смогли понять многие исторические события более глубоко. Например, удалось проанализировать процесс заселения Европы: оказалось, что сначала она заселялась выходцами из Ближнего Востока, которая имели темные волосы и глаза, постепенно гены мутировали, в результате чего, в средние века в Европе проживали уже люди со светлыми волосами и голубыми глазами. Это во многом связано с климатическими условиями, под которые поступательно мутирует организм.
Это во многом связано с климатическими условиями, под которые поступательно мутирует организм.
Интересной находкой оказалась мутация гены лактазы (это фермент, расщепляющий молочный сахар — лактозу). Изначально люди не имели способности расщеплять лактозу в течение всей жизни, а могли делать это только в младенчестве (то есть, могли употреблять молоко только в период лактации младенца). Постепенная мутация гена привела к тому, что люди стали пить молоко в течение всей жизни. Мутация впервые распространилась в популяции примерно 4 тыс. лет назад, а значит, люди стали способны употреблять в пищу молоко далеко не сразу после того, как одомашнили животных. Вероятно, люди вообще не сразу поняли, что можно употреблять в пищу молоко животных. В итоге эта привычка прижилась так основательно, что сегодня у 70 % населения планеты генетически заложены способность употреблять молоко животного происхождения всю жизнь. При этом, например, жители Китая практически не употребляют в пищу молоко и не имеют способности к расщеплению лактозы. Истерически сложилось так, что на этой территории в силу муссонного климата было слабо развито скотоводство. Таким образом, мутация гена лактазы у этих народов не формировалась.
Истерически сложилось так, что на этой территории в силу муссонного климата было слабо развито скотоводство. Таким образом, мутация гена лактазы у этих народов не формировалась.
Подводя итоги, можно сделать вывод, что научная программа «Геном человека» имела значительные плоды и внесла серьёзный вклад в развитие генетики и других наук. По неофициальным данным, на ее реализацию было затрачено 3 млрд. долларов США бюджетных средств и столько же профинансировали частные компании. В совокупности на программу ушло около 6 млрд. долларов США. Благодаря вкладу частных корпораций программа была завершена даже раньше, чем планировалось, и полностью оправдала ожидания ее создателей. Но, мы не можем останавливаться на достигнутом, поэтому эпоха научных открытий в генетике продолжается…
Конструктор жизни
Сергей Медведев: Когда я был ребенком и молодым человеком, я помню, как газеты постоянно трубили: вот-вот что-то будет, когда расшифруют геном человека, когда все эти кубики и кирпичики станут понятны… И вот геном человека расшифрован – что дальше? Появляется наука под названием «биоинформатика». Что это такое? Является ли расшифрованный геном человека неким конструктором, лего, из которого создана человеческая жизнь? У нас в гостях Михаил Гельфанд, биоинформатик, руководитель магистерской программы «Биотехнология» Сколтеха, заместитель директора Института проблем передачи информации РАН.
Что это такое? Является ли расшифрованный геном человека неким конструктором, лего, из которого создана человеческая жизнь? У нас в гостях Михаил Гельфанд, биоинформатик, руководитель магистерской программы «Биотехнология» Сколтеха, заместитель директора Института проблем передачи информации РАН.
Михаил Гельфанд: Я еще профессор факультета компьютерных наук Высшей школы экономики и факультета биоинженерии и биоинформатики МГУ.
Сергей Медведев: Как я понимаю, в геноме три миллиарда букв. Нам известен код – что мы можем сделать с этим кодом? Это некая поваренная книга жизни, мы теперь можем приготовить человека, гомункула из пробирки?
Жизнь умеет воспроизводить себя по рецептам, которые содержатся в этой книге
Михаил Гельфанд: Это поваренная книга жизни в том смысле, что жизнь умеет воспроизводить себя по рецептам, которые содержатся в этой книге. Мы не умеем, мы в этом смысле плохие повара.
Мы не умеем, мы в этом смысле плохие повара.
Вообще, эта метафора с расшифровкой и прочтением генома не очень удачна, потому что расшифровка предполагает понимание, а мы пока понимаем довольно плохо. Ту молекулу наследственности ДНК, которая была в живой клетке, а потом в пробирке, мы научились воспроизводить в компьютере, мы знаем, в каком порядке сочетаются буквы в этой молекуле. Но понимание смысла – это немножко другая вещь.
Биоинформатика появилась как самостоятельная наука ровно тогда, когда биология постепенно начала превращаться из науки, работающей с отдельными объектами, в науку, в которой очень много данных. В этот момент появляется необходимость хранить, осмыслять, анализировать эти данные и что-то с ними делать.
Сергей Медведев: Это примерно какие годы?
Михаил Гельфанд: В 1977 году разработали методы определения последовательности ДНК (я специально говорю: не «расшифровки», а «определения последовательности»). Биоинформатика начала зарождаться, по-видимому, в начале 80-х. Мне страшно повезло: когда я в 1985 году окончил университет, была такая чудесная область, в которой не надо было ничего учить, она начиналась с нуля, можно было просто брать и делать. Так очень редко бывает в истории.
Биоинформатика начала зарождаться, по-видимому, в начале 80-х. Мне страшно повезло: когда я в 1985 году окончил университет, была такая чудесная область, в которой не надо было ничего учить, она начиналась с нуля, можно было просто брать и делать. Так очень редко бывает в истории.
Сергей Медведев: В ней больше применяются математические методы?
Биоинформатика начала зарождаться в начале 80-х
Михаил Гельфанд: Методы в ней математические в следующем смысле: думать надо. Там в каких-то местах есть красивые алгоритмы, красивая статистика, но, в принципе, математика там достаточно тривиальная, никаких математических волшебных палочек там нет. Нужен навык держать в голове много всего и пытаться это по-разному объяснять, и второй навык – задавать простые вопросы. Вот в этом смысле мне было очень полезно математическое образование, даже не столько, может быть, образование, сколько общение с моим дедом Израилем Моисеевичем Гельфандом, который был математиком и очень много работал в экспериментальной биологии.
Сергей Медведев: Сейчас записан геном, определена последовательность – что мы можем из этого сделать? Я слышал, есть новая технология: мы можем взять какую-то цепочку генов и починить ее, вставить вместо нее хорошую. То есть мы можем оперировать этими буквами?
Михаил Гельфанд: CRISPR – это техника генной инженерии, одна из очень продвинутых, очень современных технологий, которая позволяет делать весьма точные и конкретные манипуляции.
У людей просто появилось больше возможностей. В принципе, вставлять и вынимать гены люди умели и раньше, просто это было тяжелее экспериментально, не любые манипуляции были технически осуществимы. Сейчас расширился набор инструментов. Можно было строить дома, как в Спарте, только топором, а теперь есть еще пила и даже лобзик, вы можете выпиливать какие-то красивые наличники. В этом смысле технологическое продвижение очень большое, но пока что не очень содержательное. Какие-то вещи мы понимаем: что есть простая моногенная болезнь, в которой сломан один-единственный ген, – понятно, что если его починить, то будет нормальный эмбрион.
Сергей Медведев: И это уже лечится?
У людей просто появилось больше возможностей
Михаил Гельфанд: Нет, это не лечится, нельзя манипулировать с человеческими эмбрионами – это просто законодательно запрещено.
Сергей Медведев: Но, как я понимаю, это движется. В Англии разрешили – с эмбрионами до 11 дней…
Михаил Гельфанд: В Китае даже спрашивать никого не будут. Вы не можете затормозить каток, подкладывая под него черепах: черепах жалко, но катку ничего не будет. В этом смысле, конечно, это будет двигаться, но человечеству надо это осмыслить. Это действительно серьезная вещь, которая требует осмысления.
Она не первая. Когда в середине 70-х годов только началась генная инженерия, когда стало ясно, что геномами можно манипулировать (тогда еще бактериальными), то уже была серьезная проблема: например, боялись, что случайно сделают какую-нибудь супербактерию, и она всех съест. Были специальные конференции, где вырабатывались правила, что мы делаем, а что не делаем. Всякий новый набор инструментов расширяет возможности, увеличивает ответственность, и он должен быть осмыслен.
Были специальные конференции, где вырабатывались правила, что мы делаем, а что не делаем. Всякий новый набор инструментов расширяет возможности, увеличивает ответственность, и он должен быть осмыслен.
Сергей Медведев: Ставит этические вопросы…
Михаил Гельфанд: А если говорить про биоинформатику, возвращаясь к тому, о чем вы спросили, то там немножко другая история. Там есть два аспекта. Оказалось, что мы можем отвечать на довольно многие классические биологические вопросы просто в компьютере.
Я много занимаюсь геномикой бактерий. Есть очень много бактерий, с которыми в их жизни был сделан один опыт, а именно: определили последовательность генома. Мы про них довольно много знаем: что они едят, что не могут есть, как они дышат, что им надо добавлять в среду, без чего они не могут выжить, а сами сделать не могут, и так далее.
Сергей Медведев: Насколько проще геном бактерии по сравнению с геномом человека?
Всякий новый набор инструментов расширяет возможности и увеличивает ответственность
Михаил Гельфанд: Это не так критично. У нас с кишечной палочкой 30% общих генов. По количеству генов типичная бактерия – это тысячи, а человек – 25 тысяч.
У нас с кишечной палочкой 30% общих генов. По количеству генов типичная бактерия – это тысячи, а человек – 25 тысяч.
Сергей Медведев: Вы целиком знаете, какой ген за что отвечает у бактерии?
Михаил Гельфанд: Не целиком, но много знаем.
Сергей Медведев: Гораздо больше, чем о человеке?
Михаил Гельфанд: В процентах – конечно.
Вторая вещь, которая появилась (и это, опять-таки, связано с технологическим развитием в экспериментальной биологии) и требует осмысления в биоинформатике, – это то, что мы можем смотреть на клетку целиком. Классическая вещь: аспирант изучает какой-то белок, он знает партнеров этого белка, знает, как этот белок взаимодействует с ДНК, если он с ней взаимодействует, знает, когда включается и когда выключается ген этого белка. Это такая полноценная диссертация, несколько научных статей про один белок. А потом появляются методы, которые позволяют отвечать на те же самые вопросы для всех белков сразу. У нас впервые появляется интегральная картина того, как устроена клетка; она сейчас очень несовершенна.
У нас впервые появляется интегральная картина того, как устроена клетка; она сейчас очень несовершенна.
Сергей Медведев: Есть белок, который вам незнаком, но вы можете предсказать, глядя на его геном…
У нас с кишечной палочкой 30% общих генов
Михаил Гельфанд: Это два разных вопроса. Мы умеем предсказывать функции белков, не делая с ними никаких экспериментов. Это красивая биоинформатика, основанная на всяких эволюционных соображениях.
Сергей Медведев: Основанная на его генном профиле?
Михаил Гельфанд: Белок – это то, что закодировано в гене, поэтому лучше говорить про ген: основанная на том, с кем этот ген лежит рядом, на кого этот белок похож из уже хотя бы немножко известных, на том, как он регулируется, когда он включается и выключается.
Сергей Медведев: То же самое, наверное, можно сделать и про человека?
Михаил Гельфанд: Это труднее.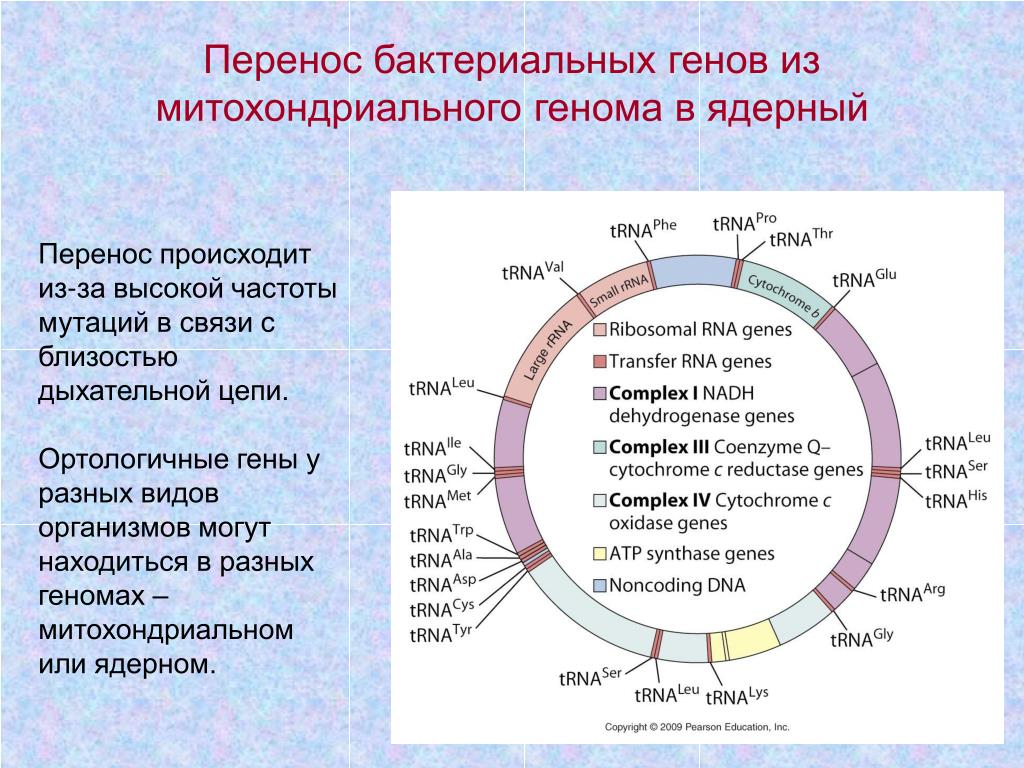 Теоретически – можно.
Теоретически – можно.
Сергей Медведев: Посмотреть на геном какого-то человека на эмбриональном уровне и сказать: вырастет гений или вырастет человек с синдромом Дауна.
Михаил Гельфанд: Это история про то, что функция белка вообще неизвестна, про нее вообще ничего не знали, и мы можем ее предсказать. А то, о чем вы говорите, это известный набор белков, но с какими-то вариациями – это немножко другая история.
Сергей Медведев: Человек состоит из известных белков.
Михаил Гельфанд: Частично – известных, частично – нет. Оказалось, что у нас очень много разнородной информации по поводу того, как устроена клетка. Информация очень несовершенная, каждый отдельный маленький фактик легко может оказаться неверным, но в совокупности они все-таки правильные. И вот из этого можно пытаться описывать клетку целиком.
Молекулярную биологию очень долго ругали философы за то, что это редукционистская наука
Молекулярную биологию очень долго ругали философы за то, что это редукционистская наука. Вот вы смотрите слона по частям: кто-то изучает ногу, кто-то – хвост, кто-то – хобот, и никакой целостной картинки не складывается. Теперь она впервые начинает складываться. Одним из парадоксальных результатов этого является то, что наши знания и понимание в абсолютном смысле увеличиваются очень быстро. В биологии прогресс потрясающий: мы знаем намного больше, чем знали 10 или 20 лет назад, даже не в разы, а на порядки больше.
Вот вы смотрите слона по частям: кто-то изучает ногу, кто-то – хвост, кто-то – хобот, и никакой целостной картинки не складывается. Теперь она впервые начинает складываться. Одним из парадоксальных результатов этого является то, что наши знания и понимание в абсолютном смысле увеличиваются очень быстро. В биологии прогресс потрясающий: мы знаем намного больше, чем знали 10 или 20 лет назад, даже не в разы, а на порядки больше.
Но еще быстрее увеличивается область незнания. То есть относительное наше знание на самом деле, по-моему, убывает, так как становится понятно, что есть такие просторы, про которые десять лет назад нам просто в голову не приходило, что такое бывает. А теперь мы видим, что это есть, но не знаем, что с этим делать. Вот это страшно прикольно.
Михаил Гельфанд
У кого будет синдром Дауна – это понятно: лишняя хромосома. А вот кто будет, а кто не будет гением, мы не умеем предсказывать, и слава богу. Мы даже рост плохо умеем предсказывать.
Сергей Медведев: Не идет накопление этой информации?
Михаил Гельфанд: Идет, конечно.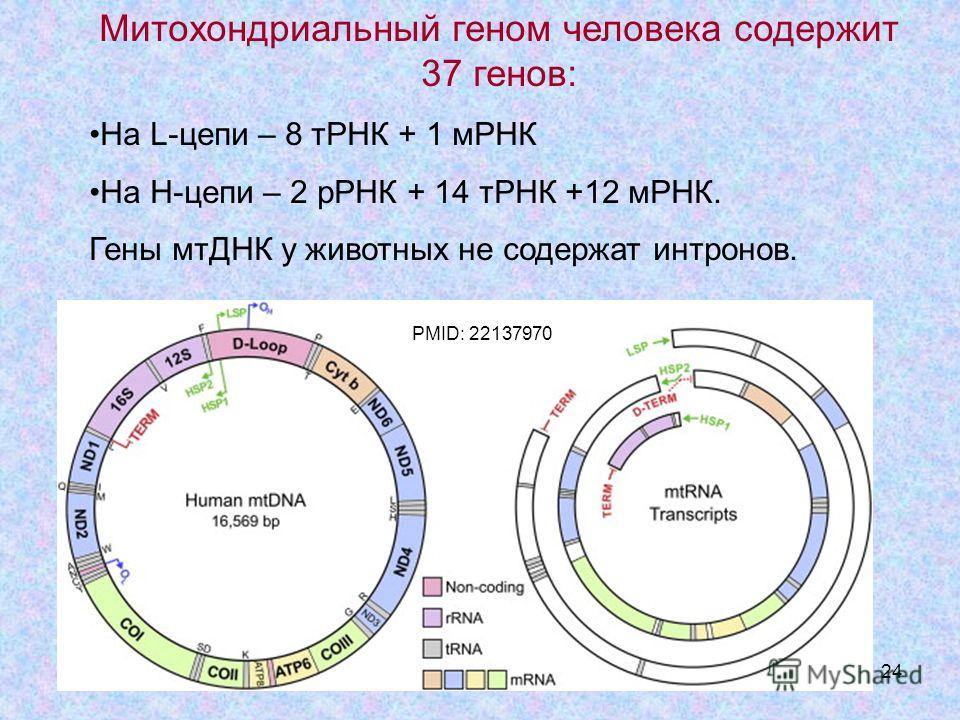
Сергей Медведев: Можно ли, скажем, сопоставлять поведение человека, его профиль в соцсетях с его генетическим профилем?
Михаил Гельфанд: Про это я не знаю, а вот психологические черты частично определяются геномом, и их можно немножко предсказывать.
Сергей Медведев: Частично – геномом, частично – обществом.
Психологические черты человека частично определяются геномом, и их можно немножко предсказывать
Михаил Гельфанд: Обществом, какими-то жизненными обстоятельствами… В генетике это разработанная вещь, вы можете количественно оценить вклад генетических факторов в тот или иной признак. Давайте возьмем кого-нибудь одного – меня. У меня во всех клетках геномы одинаковые, а клетки у меня разные.
Сергей Медведев: То есть в какой-то момент геномы понимают, в какую клетку им развиться?
Михаил Гельфанд: В какой-то момент клетка понимает, что она должна стать предшественником эпителия или нервной системы, или печенки, или чего-то еще. После первых делений все клетки одинаковые, гены в них работают одинаково, а потом начинают работать по-разному. Ключевая вещь на самом деле – не сами гены: у меня и у шимпанзе 50% белков одинаковые, а те, что разные, отличаются на одну букву.
После первых делений все клетки одинаковые, гены в них работают одинаково, а потом начинают работать по-разному. Ключевая вещь на самом деле – не сами гены: у меня и у шимпанзе 50% белков одинаковые, а те, что разные, отличаются на одну букву.
Сергей Медведев: То есть вопрос в том, где та программа, которая в какой-то момент говорит клетке, что она должна развиться в человека или в шимпанзе, а в человеке – в мозг или в печень.
Михаил Гельфанд: Он там же, в генах, но ключевая вещь – не сами гены, а то, как они включаются и выключаются. И вот это – самое интересное, что сейчас происходит в биологии.
Сергей Медведев: А есть программа, которая включается и выключается?
Есть мутации, когда у дрозофил вместо усика вырастает нога
Михаил Гельфанд: Конечно. У дрозофил это хорошо известно. Дрозофила простая, зародыш у нее тоже простой… Нет, дрозофила сложная, но ранние этапы ее развития очень хорошо описаны именно количественно на уровне моделей. Например, можно предсказывать результаты мутаций. Есть мутации, когда у дрозофил вместо усика вырастает нога. При этом известно, в каком гене мутация, что сломано, и это можно смоделировать – как ошибаются клетки-предшественники.
Например, можно предсказывать результаты мутаций. Есть мутации, когда у дрозофил вместо усика вырастает нога. При этом известно, в каком гене мутация, что сломано, и это можно смоделировать – как ошибаются клетки-предшественники.
Сергей Медведев: А можно это починить с новыми технологиями?
Михаил Гельфанд: Можно, но только у зародыша. Когда выросла нога или лишняя пара крыльев, уже не починишь.
Сергей Медведев: Что это может принести в практическом смысле? Скажем, то, что интересует каждого человека, – борьба с раком… C этой потрясающей технологией CRISPR китайцы, кажется, пытаются бороться с раком легких. Как я понимаю, в этой технологии бактерия, когда она видит у себя фрагмент сломанной ДНК, берет кусочек у здоровой бактерии и замещает сломанную цепочку здоровой.
Михаил Гельфанд: Да, только интересный вопрос, что происходит со здоровой бактерией… Нет, не так. CRISPR/Cas-системы – это бактериальный иммунитет, немножко другая вещь. Когда бактерию заражает вирус, если он не успел ее убить, там начинается война, вирус переключает какие-то бактериальные системы, ломает бактериальную генетическую программу и переключает бактерию на производство новых вирусов. Собственно, все вирусы так делают: и бактериальные, и человеческие, и какие угодно. Есть система, которая позволяет бактерии, если вирус не успел ее убить в самом начале, вырезать кусочек ДНК вируса и использовать как образец при следующей атаке такого же вируса.
CRISPR/Cas-системы – это бактериальный иммунитет, немножко другая вещь. Когда бактерию заражает вирус, если он не успел ее убить, там начинается война, вирус переключает какие-то бактериальные системы, ломает бактериальную генетическую программу и переключает бактерию на производство новых вирусов. Собственно, все вирусы так делают: и бактериальные, и человеческие, и какие угодно. Есть система, которая позволяет бактерии, если вирус не успел ее убить в самом начале, вырезать кусочек ДНК вируса и использовать как образец при следующей атаке такого же вируса.
Сергей Медведев: Бактерия сама себя прививает этим вирусом.
Типичный признак рака – когда гены, которые работают на эмбриональных стадиях, начинают работать во взрослых тканях
Михаил Гельфанд: В каком-то смысле – да. А дальше оказалось, что есть белок, который способен вырезать кусок и целенаправленно его куда-то вставить, и вы этот же самый фермент можете использовать для целей генной инженерии.
Про такую терапию рака я не очень понимаю: когда у вас есть миллиарды клеток, как вы собираетесь в каждую из них встроить правильную систему? Я не понимаю, как это технически сделать. Это можно делать для лечения генетических дефектов на стадии эмбриона, когда там одна клетка.
С раком история немножко другая, там действительно очень существенный прогресс. Стало ясно, что то, что мы принимали за одну и ту же болезнь, это на самом деле на молекулярном уровне – разные болезни, и мишени для терапии тоже должны быть разные. Рак сначала классифицировали просто по месту: был рак легких, рак желудка, рак кожи. Потом началась гистология. Когда стали смотреть на структуру опухоли, на то, из каких клеток она состоит, начались диагнозы типа «мелкоклеточный рак легких». Потом началась биохимия, стали смотреть какие-то маркеры, это раздробилось еще дальше.
А теперь мы можем посмотреть, какие, собственно, произошли мутации. Вы берете образец из раковой опухоли и образец из такой же нормальной ткани, и смотрите, чем они отличаются. Они очень сильно отличаются, потому что при раке все ломается, ошибки начинают накапливаться очень быстро. Есть специальные термины – «водители» и «пассажиры»: какие-то из этих ошибок – пассажиры, они получились случайно, а какие-то были водителями, они, собственно, и привели к перерождению.
Там получаются совершенно практические вещи, потому что, например, ясно, что какие-то раки, которые считали одной болезнью, надо лечить по-разному. И наоборот, если у вас внешне разные раки, но у них одна и та же молекулярная поломка, то вы можете лекарство, эффективное против одного, пытаться использовать против другого.
Сергей Медведев: Это поломка на генетическом уровне, выбит какой-то ген?
Михаил Гельфанд: Или выбит, или, наоборот, начал работать слишком интенсивно. Типичный признак рака – когда гены, которые работают на эмбриональных стадиях, начинают работать во взрослых тканях. Эти клетки начинают бесконтрольно делиться. Довольно многие раки – это на самом деле перерождение, деградация назад во времени.
Биоинформатика – это не наука в том же смысле, в котором не является ею электронная микроскопия, – это набор приемом
Я сразу хочу подчеркнуть: я не медик, я про это знаю как биолог и человек, немножко читающий обзоры. Я просто всегда очень боюсь разочаровывать людей. Всегда есть баланс между успехами в науке и практическим вопросом – для тех, кому завтра идти лечиться. Это экспериментальные вещи. Есть единичный пример, когда это работало. Но ясно, что именно в этом направлении все и будет происходить.
Сергей Медведев: Если посмотреть медицинское применение, вы видите, что уже пойдет генная инженерия, генная терапия? Сейчас, насколько я понимаю, на отдельных аутоиммунных заболеваниях видно, что какой-то один ген сломан.
Михаил Гельфанд: Это, скорее, наоборот, дефект иммунной системы, выбитая иммунная система. Это пытаются лечить.
Сергей Медведев: Иммунодефицит на генном уровне?
Михаил Гельфанд: Это связано со спецификой иммунной системы. Там клетки все время делятся, все время возникают новые клоны. Даже если у вас все дефектное, но вы сделали небольшое количество починенных клеток-предшественников, то они могут заместить всю систему иммунитета, породить ее заново. Это связано как раз со спецификой того, как вообще устроена иммунная система. Она в этом смысле потрясающе пластична.
Сергей Медведев: Бактерия создала себе некую прививку, иммунитет?
Михаил Гельфанд: Да, но там немножко другое. Опять-таки, когда речь идет об иммунодефиците, это означает, что вообще нет каких-то классов клеток, потому что сломан тот ген, который должен работать, когда эти клетки созревают. Если вы почините этот ген каким-то предшественникам, они созреют в эти клетки, то они дадут начало всей этой большой иммунной картине.
Сергей Медведев: Есть же еще, как я понимаю, вычислительная эволюционная биология. Вы можете откатиться назад и посмотреть ген древнего человека?
Наши отличия от мышки начинаются на первых стадиях эмбриона, а потом уже все фиксируется
Михаил Гельфанд: Это почти самое интересное. Биоинформатика – это не наука в том же смысле, в котором не является ею электронная микроскопия, – это набор приемов. Научная часть биоинформатики, это, во-первых, то, что связано с биологией развития, а во-вторых, это молекулярная эволюция, и там можно делать разные чудесные вещи.
Мы гораздо лучше понимаем, как это происходило. Наши отличия от мышки начинаются на первых стадиях эмбриона, а потом уже все фиксируется. Одни и те же гены работали немножко в разных комбинациях. Эта мечта описать разнообразие животных с пониманием того, как они возникали, идет еще от Геккеля. Геккель многое подтасовывал, за что его и ругают, но сама по себе идея очень правильная. Чтобы понять отличие человека от мыши, надо смотреть не взрослого человека и взрослую мышь, а эмбрионы на первых стадиях. Это сейчас становится реальным.
Вторая вещь: мы понимаем, кто кому родственник, просто сравнивая геномы. Понятно: чем меньше отличий, тем ближе родство. Это очень простая идея, ее можно алгоритмизировать. Наши представления об эволюции живых существ вообще довольно сильно поменялись. Традиционно грибы всегда изучали на кафедре низших растений, а на самом деле грибы никакие не низшие растения, а наши ближайшие родственники. Нам с грибами цветочки – двоюродные. Из этого следует, что многоклеточность возникала много раз независимо, а это уже очень принципиальный вопрос. Когда мы с вами учились в школе, были бактерии, потом были простейшие, а потом простейшие начали слипаться и получились многоклеточные, а потом многоклеточные разделились на растения и животных. Были какие-то низшие растения, грибы и высшие растения – розы и лютики. А на самом деле не так: было много разных одноклеточных, и в этих разных линиях одноклеточных несколько раз независимо возникала многоклеточность.
Сергей Медведев: Человек как высшая форма многоклеточности?..
Грибы никакие не низшие растения, а наши ближайшие родственники
Михаил Гельфанд: Я не знаю, в каком смысле высшая. Если смотреть по разнообразию тканей, то все млекопитающие в одну цену. Если смотреть по сложности нервной системы, то нас надо сравнивать с осьминогами. Но если кому-то приятно быть антропоцентристом, то на здоровье, я не возражаю.
Наше представление о происхождении человека очень сильно поменялось. В каждом из нас 2% неандертальца, а еще были денисовцы (денисовский человек), про которых вообще никто не подозревал. На самом деле в Евразии 40 тысяч лет назад было три независимых ветки человечества, они скрещивались во всех сочетаниях, и остатки этих скрещиваний мы видим в геноме.
Сергей Медведев: Это вы все берете по останкам того, что осталось на стоянках?
Михаил Гельфанд: Это старая ДНК и анализ современной ДНК разных людей. По-моему, это очень здорово. Это очень сильно перекашивает мою картину мира.
Сергей Медведев: Михаил, вы нас озадачили. 2% неандертальцев, зато очень много общего с грибами, с цветами… Действительно, здесь идет речь о кубиках, из которых устроена жизнь. Сейчас, как я понимаю, вы эти кубики комбинируете в разном порядке, смотрите, какие признаки произошли и в онтогенезе, и в филогенезе, как развился эмбрион отдельного человека, как вообще развилась жизнь на Земле.
Михаил Гельфанд: Да. Мы делаем это в компьютере, а экспериментаторы делают в клеточках.
Мы живем в восхитительное время!
Сергей Медведев: Мы живем в восхитительное время! Будем надеяться, что эти эксперименты приведут и к созданию лекарств от рака и СПИДа.
Михаил Гельфанд: Вообще-то лекарство от рака уже создали.
Сергей Медведев: Я имею в виду понимание механизмов действия.
Михаил Гельфанд: А с диагнозом СПИД люди живут и живут на современных лекарствах.
Сергей Медведев: Вопрос не о лекарствах, а о том, чтобы лечить это на генном уровне. Это дальнейшее пожелание.
«Меня уже секвенировали, и я выжил». К чему приведет расшифровка генома жителей Фарерских островов?
Боги Элиасен — основатель, «главный архитектор» проекта Fargen. Его цель — расшифровать геном каждого жителя Фарерских островов, собрать информацию в цифровом виде и упорядочить ее. Что это даст и как быть с этическими вопросами?
Боги Элиасен — «брокер знаний», тот самый специалист, который «приводит к общему знаменателю» экспертов и информационные потоки из различных областей ради достижения новой цели. О себе говорит, что он политолог, а не специалист по генетике. Будучи экспертом в сфере международной политики, права, а также активно изучая тему будущего мирового здравоохранения, Элиасен запустил амбициозный проект Fargen.
Цель проекта — расшифровать геном каждого жителя Фарерских остовов, собрать информацию в цифровом виде и упорядочить ее. И пусть население Фарерских островов по сравнению с многими другими странами невелико — около 50 тысяч человек, — это колоссальный объем данных. Геном — это более 3 млрд нуклеотидов. Секвенированный (расшифрованный) геном лишь одного человека «весит», по разным оценкам, в среднем 500 гигабайтов. Впрочем, это приблизительные данные. Как отмечают в компании «Генотек», исходный геном занимает около 6 гигабайтов, а объем расшифрованных данных зависит только от характера и цели исследования.
Эти данные будут использовать в качестве материала для научных исследований. Впоследствии, как надеются организаторы, результаты встроят в национальную систему здравоохранения и смогут эффективно использовать при лечении каждого фарерского пациента. Кроме того, анализ этих данных может помочь многим пациентам в разных странах мира, и это обширное поле для международного сотрудничества. Поле, впрочем, минное: вопросы обработки, хранения и передачи персональных данных такого рода еще не проработаны на международном уровне в силу новизны. На конференции по персонализированной медицине, организованной компанией Roche, Business FM и N+1 поговорили с Боги Элиасеном об этике и практике.
BFM: Это красивая теория или программа уже имеет практическое применение и есть активный приток участников?
Боги Элиасен: Программа уже идет, продвигается пока медленно. На мой взгляд, важно поставить цель, когда что-то начинаешь. Когда мы затеяли этот проект, вопрос цели был очень актуален. С одной стороны, мы понимали идею с геномикой (раздел молекулярной генетики, посвященный изучению генома и генов живых организмов. — Business FM). С другой — в довольно маленьком обществе секвенировать всех подряд — почему вдруг? Если мы делаем это, то какова научная ценность проекта в конце? И в этом причина того, что данный научный проект организован несколько иначе, чем обычно организован любой другой.
BFM: И как же вы определили цель?
Боги Элиасен: Быть частью Новой биологии, частью которой уже является геномика. Мы исходим из того, что в малых обществах без серьезной внутренней работы можно серьезно отстать. Чтобы создать систему здравоохранения, нужны надежные партнеры, точки опоры, с которыми можно сотрудничать.
N+1: Ваш проект кажется похожим на исландский, вы используете тот опыт?
Боги Элиасен: Наш проект несколько отличается. В Исландии этим занимается частная компания deCODE, их результаты исключительно хороши, сами результаты можно сравнивать лишь частично, но да, есть некоторые знания, которые мы применяем.
N+1: Результаты вашей работы уйдут правительству?
Боги Элиасен: Смотря как вы определяете понятие «правительство». Но в целом скорее да, эти данные попадут в систему здравоохранения.
BFM: Кто курирует программу? Министерство здравоохранения? Высоких технологий?
Боги Элиасен: Министерство здравоохранения. Но в таком государстве, как Фареры, между структурами есть доверие, как мало в какой другой стране, я думаю.
N+1: Вы кого-то уже секвенировали?
Боги Элиасен: Да. Меня в том числе. И я выжил. (Смеется.)
BFM: Так у вас уже есть опыт?
Боги Элиасен: Да, меня секвенировали несколько раз. Я участвовал в таких проектах, как Online Gemics, 23andMe, National Geographic и других. Что я узнал? Информации действительно очень много, но мы находимся в самом начале пути по изучению всего этого, и многое было бы здорово узнать. Вполне очевидным становится то, что наш способ работы с довольно ограниченными биологическими данными и в целом при ограниченном использовании данных в системе здравоохранения — это абсурд, именно так начинаешь думать, когда понимаешь, сколько еще предстоит узнать. Это нас убеждает двигаться дальше.
BFM: Есть ли столь же убежденные участники программы? Много ли их появляется?
Боги Элиасен: Участники прибывают медленно. Но это из-за стоимости проекта, а не из-за недостатка желающих. В малых обществах не очень много приватности — люди друг друга знают. Но из-за того что исследование очень много внимания уделяет специфическим заболеваниям, характерным для Фарер, при малой популяции есть понимание того, насколько оно ценно. Много внимания было к ценности генетических исследований, знаний. Для семей, в которых есть носители заболеваний — редких в мире, но более сконцентрированных на Фарерских островах, — это хорошая возможность получить точные данные скрининга, и для них это жизненно важно.
BFM: По поводу международного обмена данными. Думаете, было бы логично запустить исследования такого рода в более крупных странах? Или для Индии или Китая это все же избыточно?
Боги Элиасен: Китай начинает работу с такими данными примерно в том же ключе, но их подход диаметрально противоположен. В Китае сейчас развивается огромная активность по секвенированию и мониторингу данных — в рамках системы социального кредитования и прочего. Но подход, который использует эта страна, совершенно неприменим для европейской модели или Северной Америки. Тем не менее они этим заняты, они получат определенный объем знаний, который потом будет использован, в мире в том числе. Мы еще увидим разные подходы к получению этих знаний.
BFM: Разрабатывается ли система стандартизации информации, полученной при генетических исследованиях? У Фареров один подход, у Китая другой — как все это систематизировать?
Боги Элиасен: Я работаю по большей части с объединенными проектами по северным странам. Когда начинаешь работать с геномикой, например применительно к таким заболеваниях, как рак, сталкиваешься с тем, что все заболевания автоматически становятся редкими. Популяция в 5-10 млн — это очень мало, нужно работать с большим охватом. Поэтому чисто национальные специфические подходы не будут применимым, работающим решением при анализе данных. Думаю, что в мире должно быть больше «слияния» при работе с такими данными.
BFM: Может ли в обозримом будущем появиться такой международный стандарт для подобных данных? Или пока вообще слишком рано говорить о самой возможности?
Боги Элиасен: В геноме 3,2 млрд базовых пар, и мы в действительности не знаем, как они взаимодействуют. Это системный биологический подход. Реализовать его очень сложно. Нам нужно понять, каким именно образом мы можем взаимовыгодно взаимодействовать — ученые, медики, общество, страховщики, фармкомпании. Когда мы придем к пониманию того, какие именно преимущества кому это приносит, тогда, я думаю, мы сможем получить единый стандарт.
BFM: Двигателем этого процесса будут фармкомпании? Правительства? Ученые вряд ли будут активны в этом смысле.
Боги Элиасен: Думаю, что ученые в принципе делятся меньшим объемом данных, чем та же фарма. Ученым нужно будет становиться более этически ответственными. Но сам двигатель процесса будет таким, какой мы не можем себе сейчас представить в обществе с такой поляризацией. Будет движение в мировом сообществе, в международном масштабе. Конечно, и бизнес будет ему способствовать. Но бизнес будет не обязательно развивать именно передачу данных вовне, так что тут не стоит обобщать. Национальные системы здравоохранения, компании, которых сегодня еще нет на рынке медицинских услуг, множество цифровых компаний появятся в этом секторе. Но в итоге все придет к тому, что будет обеспечена поддержка национальных систем здравоохранения. Сейчас им все время приходится покупать и покупать инновации, а результаты не всегда становятся лучше. Мы используем все инновации, чтобы улучшить оставшиеся условно три месяца жизни вместо того, чтобы сделать саму жизнь более продолжительной и качественной. Если страховщики разглядят то, что на самом деле эти данные дают огромные преимущества как для клиентов, так и для самих компаний, возможно, они и станут основной движущей силой к разработке международного стандарта данных.
BFM: Но это ведь означает изменение подхода к их бизнесу?
Боги Элиасен: Возможно, но и они ведь живут в другом мире. Теперь нет ситуации, когда они обладают более качественными данными, чем клиент. Это нужно учитывать.
BFM: А как будут выглядеть те самые данные, которыми так здорово было бы обмениваться? «Имя, фамилия, генетические данные»? Или это будет анонимизированная информация?
Боги Элиасен: Это, конечно, огромный вопрос. Вариантов множество. Прежде всего необходимо понять, идет ли речь о данных исследований или о клинических медицинских данных. В случае с медицинскими данными анонимность не сработает, поскольку нужно в том числе показать привязку пациента к медучреждению. Весь шум вокруг анонимных данных сводится к тому, что да, так можно делать, если ты на сто процентов уверен, что алгоритмы, которые работают с этими данными, безошибочны. Ведь если мы не получили в итоге качественные данные, чтобы лечить пациента, мы ничего не выиграли. Есть огромные вопросы — с государственным участием, в частности. И дело не только в безопасности. Вы можете вообще не захотеть делиться таким объемом данных о себе с государством, ведь информация — это сила, это вопрос о том, с кем вы захотите разделить власть обладания информацией. Да, допустим, вы готовы предоставить о себе определенные данные, но вопрос, для чего они будут использованы. Если у тебя нет доступа к оригинальным, «корневым» данным, есть вещи, которых ты не сможешь сделать. Нужно ли тебе сравнить какие-то данные исследований или изучить тысячу пунктов, включая генетическую информацию и фенотип. Все эти модели работы с информацией, подходы к анализу нам нужно разработать.
В 1990 году стартовал проект «Геном человека». Он должен был определить последовательность нуклеотидов, составляющих ДНК, и идентифицировать 20-25 тысяч генов в человеческом геноме. Большая часть работ по секвенированию была закончена к концу 2003 года, но некоторые участки ДНК не расшифрованы до сих пор.
Многие страны проявляют заинтересованность к возможностям получения и анализа генетической информации и собирают генетические «базы данных». Среди крупнейших проектов такого рода можно назвать, например, британский UK Biobank, китайский проект «3 млн геномов» (3-Million Genomes Project), исландский проект по полной расшифровке геномов 2636 человек, осуществленный компанией deCODE.
Проект «Геном человека
» | Геном: открытие кода жизни
Проект «Геном человека» (HGP) стартовал в 1990 году как сотрудничество международных исследователей, общей целью которых было составить карту и понять все гены человека. Весь генетический материал человека, вместе взятый, включая все гены и другие элементы генома, составляет его «геном».
Ученые HGP использовали несколько подходов для декодирования генома человека: они изучили порядок, или последовательность , из более чем 3 миллиардов оснований в ДНК человека.Они составили карты, показывающие расположение генов на наших хромосомах — непростая задача, учитывая 20 500 генов в геноме человека. И они создали карт сцепления , которые можно использовать для отслеживания наследственных признаков, таких как генетические заболевания, на протяжении многих поколений.
Рабочий проект генома человека был опубликован в феврале 2001 г. [Nature, 15 февраля 2001 г.], а в апреле 2003 г. было завершено и опубликовано секвенирование полного генома человека.
Расшифровка первой последовательности генома человека заняла от шести до восьми лет активного секвенирования и стоила около 1 миллиарда долларов.Сегодня геном человека можно секвенировать за один-два дня и стоит от 4000 до 5000 долларов. Дальнейшее сокращение — до менее чем 1000 долларов — ожидается в ближайшие несколько лет.
Конечным достижением HGP было предоставление миру подробной информации о структуре, организации и функции полного набора человеческих генов — «набора инструкций» для человека. Проект также способствовал гигантскому скачку в наших знаниях о нарушениях, вызванных дефектами одного гена. До начала HGP мы знали генетические основы около 60 редких генетических заболеваний; когда он закончился, число подскочило до 2200.Сегодня, благодаря исследованиям, инициированным HGP, мы знаем геномную основу почти 5000 редких заболеваний.
Инструменты и технологии, созданные для достижения этой цели, также использовались для декодирования геномов исследуемых организмов, таких как мыши, круглые черви и дрозофилы. Секвенированы геномы собак, кошек, коров, свиней, даже опоссума и утконоса. В 2003 году исследователи секвенировали геномы трех позвоночных животных; Сегодня известно 112 последовательностей генома позвоночных.
Отличительной чертой масштабных международных исследований HGP была его приверженность открытости, быстрому обмену информацией между исследовательскими группами по мере ее обнаружения и предоставлению ученым всего мира беспрепятственного доступа к данным о человеческой последовательности.Информация, полученная с помощью HGP, продолжает широко распространяться, с постоянным стремлением анализировать ее этические, правовые и социальные последствия, а также соответствующие варианты политики.
Ресурсы
Наука, лежащая в основе проекта «Геном человека»
. Объяснение часто используемых генетических терминов, таких как ДНК, хромосома, геном, протеом, и их взаимосвязи друг с другом и с проектом «Геном человека»; от Министерства энергетики США
Ссылка непосредственно на содержание:
Human Genome Project
Китайский BGI заявляет, что может секвенировать геном всего за 100 долларов
«Эти системы будут приоритетными для действительно крупномасштабной популяционной генетики, проектов с участием миллиона человек», — говорит Рейд Дрманак, главный научный директор подразделения Complete Genomics. компании BGI Group в Сан-Хосе, Калифорния, которая разработала новую технологию.
Конкуренция Китая
BGI была основана два десятилетия назад во время участия Китая в проекте «Геном человека». С тех пор он превратился из исследовательского института, который расшифровал ДНК панд и рисовых растений, в разросшийся конгломерат, активно занимающийся клонированием животных, тестированием здоровья и исследованиями по контрактам.
Хотя BGI не объявила о каких-либо заказчиках системы, известной как DNBSEQ-TX, претензия в 100 долларов может вновь вызвать опасения, что США, возможно, потерпели неудачу в технологическом лидерстве, позволив китайской фирме приобрести Complete Genomics в 2012 году.
Complete — это находившийся в затруднительном положении стартап, внедряющий инновации, сделанные Дрманаком, сербским эмигрантом с историей умных идей для секвенирования ДНК. Но компании требовались дополнительные инвестиции, и она еще не могла конкурировать с Illumina, поэтому она приняла предложение BGI о приобретении со скидкой около 120 миллионов долларов.
В то время Illumina пыталась разорвать сделку, сравнивая сделку с продажей Китаю «формулы для кока-колы». Он обратился в Министерство торговли с просьбой заблокировать поглощение по соображениям национальной безопасности, сославшись на риск того, что иностранное предприятие получит данные ДНК американцев.
Однако сделка состоялась, несмотря на попытки Illumina «устранить ближайшего конкурента», как выразились руководители BGI.
Обе компании продолжают подавлять и парировать патентные иски. Каждый обвиняет другого в использовании запатентованных технологий, и до прошлой недели BGI не предлагала продавать свои инструменты на рынке США. У него есть существующая линейка из четырех моделей продуктов, которые стоят до 1 миллиона долларов и продаются дочерней компанией MGI.
Как это работает
Современное сверхбыстрое секвенирование работает по принципу «синтеза.То есть геном человека разбивается на миллиарды коротких участков ДНК и фиксируется на поверхности чипа. Затем добавляются свежие химические буквы ДНК, образующие пары по этим фрагментам. В процессе постепенно накапливаются или синтезируются совпадающие цепочки генетической информации.
Определяя порядок добавления букв, машины определяют последовательность этих миллиардов фрагментов. Затем данные собираются вместе на компьютере, чтобы создать полную карту генома человека.
Используя свою собственную версию секвенирования путем синтеза, Illumina представила «геном за 1000 долларов» в 2014 году и через три года заявила, что в конечном итоге может снизить цены до 100 долларов. Но пока этого не произошло.
Компания «ждала, когда, по нашему мнению, настало время», — сказал инвесторам в прошлом году генеральный директор Фрэнсис де Суза.
Теперь цены могут устанавливаться BGI. В феврале бостонский стартап Nebula Genomics начал предлагать потребителям пройти секвенирование всего за 299 долларов. Низкая цена предложения «персональный геном» возможна, потому что Nebula отправляет образцы мазков из щеки в лабораторию BGI в Гонконге для декодирования.
«Последние пять лет стоимость секвенирования генома держится на уровне 1000 долларов. Я не думаю, что это связано с технологической стагнацией, а потому, что у Illumina есть монополия », — говорит Деннис Гришин, соучредитель Nebula.
Снижение затрат в системе BGI достигается за счет использования огромного чипа размером с фрисби, элементы которого находятся на расстоянии всего 500 нанометров друг от друга, а также за счет использования роботизированного манипулятора для погружения чипа в химические ванны, которые можно использовать повторно. «Благодаря окунанию мы получаем вдвое больше ДНК и в три раза меньше реагентов», — говорит Дрманак.
У прототипа системы нет прейскурантной цены, потому что он будет «производиться на заказ» только для крупнейших генетических центров. По словам Дрманака, на выполнение анализа уйдет три полных дня, но за один раз будет сброшено 700 геномов.
Неограниченное секвенирование
Неизвестно, насколько будет интересен супер-секвенсор Drmanac. По словам Габриэля из Института Броуда, в настоящее время в США нет ни финансирования, ни спроса на какой-либо центр для секвенирования 100 000 геномов в год.
Однако это может измениться по мере появления какой-то крупной инициативы. Например, проект, финансируемый Национальными институтами здравоохранения «Все мы», направлен на создание базы данных о здоровье, содержащей последовательность действий одного миллиона американцев-добровольцев. В Великобритании уже проводится секвенирование 500 000 человек в рамках своей национальной программы.
Если секвенирование генома станет еще дешевле, оно может стимулировать использование новых тестов крови для раннего выявления рака и измерения микробиомов людей (их кишечных бактерий), приложений, которые также полагаются на высокопроизводительное секвенирование ДНК.В Китае версии технологии Dramnac уже используются для проведения пренатальных тестов на миллионах женщин.
«В Китае ежегодно рождается 20 миллионов новорожденных. Они очень быстро проверят каждую беременную женщину », — говорит он. «Я хочу довести это до неограниченной последовательности миллиардов людей».
BGI, использующая на своем веб-сайте слоган «Omics для всех», чувствительно относится к тому, что ее рассматривают в первую очередь как китайскую операцию, которая может запутать ее в торговых спорах и спорах о национальной безопасности.
Но Дрманак говорит, что не сожалеет, что Complete Genomics была продана BGI, компании, которая, по его словам, думает о долгосрочных перспективах и не придерживается «краткосрочного взгляда на Уолл-стрит».
«Я гражданин мира и ученый, который борется за развитие науки», — говорит он. «Я очень рад, что мы объединились с BGI, потому что они стремятся донести эту технологию до всех. Они хотят решить большие проблемы, с которыми может справиться геномика, и единственный способ — сделать это доступным ».
Стоимость декодирования генома снижена
Инженер из Стэнфорда изобрел новую технологию декодирования ДНК и использовал ее для декодирования своего собственного генома менее чем за 50 000 долларов.
Инженер Стивен Р. Квейк говорит, что низкая стоимость «демократизирует доступ к плодам геномной революции», позволяя многим лабораториям и больницам декодировать целые геномы человека.
До сих пор только компании или центры секвенирования генома, оснащенные большим персоналом и сотнями машин, могли расшифровать три миллиарда единиц в геноме человека.
Аппарат доктора Квейка, секвенсор одной молекулы Heliscope, может расшифровать или секвенировать геном человека за четыре недели с помощью персонала из трех человек.Машина производится основанной им компанией Helicos Biosciences и стоит «около 1 миллиона долларов, в зависимости от того, насколько сильно вы торгуете», — сказал он.
Только семь геномов человека были полностью секвенированы. Они принадлежат Дж. Крейгу Вентеру, пионеру декодирования ДНК; Джеймс Д. Уотсон, один из первооткрывателей двойной спирали ДНК; два корейца; китаец; йорубан; и жертва лейкемии. Геном доктора Квейка кажется восьмым полным геномом, не считая мозаики людей, чьи геномы были расшифрованы в рамках проекта «Геном человека».
Статья, описывающая расшифровку генома доктора Квейка, опубликованная в понедельник в Nature Biotechnology, показывает степень совпадения вариаций ДНК в его собственном геноме и в геноме доктора Вентера и доктора Ватсона.
В течение многих лет ДНК секвенировалась методом, разработанным Фредериком Сэнгером в 1975 году и использованным для секвенирования первого генома человека в 2003 году, что, вероятно, стоило не менее 500 миллионов долларов. Несколько технологий секвенирования следующего поколения сейчас разрабатываются и постоянно совершенствуются каждый год.Технология доктора Квейка — это новая запись в этих скачках.
Доктор Квейк подсчитал, что расшифровка последнего секвенированного генома человека стоит 250 000 долларов, а стоимость его машины составляет менее одной пятой этой стоимости.
«Есть четыре коммерческих технологии, нет ничего статичного, и все платформы каждый год улучшаются в два раза», — сказал он. «Мы вот-вот увидим, как открываются шлюзы, и многие человеческие геномы секвенируются».
Он сказал, что широко обсуждаемая цель генома в 1000 долларов может быть достигнута за два или три года.При такой цене, как давно предсказывали эксперты, секвенирование генома может стать рутинной частью медицинской практики.
Препятствием для медицинского использования геномов, однако, быстро становится не технология, а способность понимать и интерпретировать то, что открывает технология.
ПОДРОБНОЕ ОПИСАНИЕ На этих изображениях показаны светящиеся точки, в которых флуоресцентные химические вещества используются для определения местоположения нуклеотидов в молекуле ДНК. Кредит … Helicos
Поиски по раскрытию генетических корней сложных заболеваний, таких как рак, диабет или болезнь Альцгеймера, основная цель проекта «Геном человека», который недавно застопорился.Оказывается, что большинство этих заболеваний вызвано не несколькими распространенными вариантами, как ожидали многие биологи, а неуправляемым количеством редких вариантов, по большей части не предлагающих четкой цели для лекарств или диагностики.
Эта генетическая сложность нарушила многие планы персонализированной медицины, потому что для сложных заболеваний и черт не существует очевидного способа предсказать состояние человека в целом по его последовательности ДНК.
Намного лучше известно о генетической основе многих простых болезней, вызываемых одним генетическим вариантом, но большинство из этих болезней редки и составляют небольшую часть общего бремени болезней.
Тем не менее, люди, пытающиеся проанализировать свою собственную последовательность ДНК, скорее всего, найдут один или несколько вариантов болезни с одним геном, потому что они пока единственные, понятные.
Доктор Квейк сказал, что аналитики аннотировали его геном и обнаружили вариант, связанный с болезнью сердца. К счастью, доктор Квейк унаследовал этот вариант только от одного родителя; другая его копия гена хороша.
«У вас должен быть крепкий желудок, когда вы смотрите на свой собственный геном», — сказал он.
Доктор Квейк сказал, что он обнародовал последовательность своего генома, как это сделали доктор Вентер и доктор Ватсон, чтобы ускорить распространение знаний.
«Ученые придерживаются строгой этики при обмене данными», — сказал он. «Геномы Вентера и Ватсона были невероятно полезны при анализе моего, и я надеюсь, что мой будет полезен и для других».
Некоторые эксперты полагают, что выход из нынешнего тупика в понимании причин сложных заболеваний лежит в секвенировании полных геномов многих людей, включая пациентов, страдающих определенными заболеваниями.Более дешевые методы секвенирования должны помочь в достижении этой цели.
Джордж Черч, ведущий биотехнолог Гарвардской медицинской школы, сказал, что для клинической генетики последовательности ДНК необходимо декодировать с точностью до одной ошибки на каждые 10 000–100 000 единиц ДНК. Доктор Квейк сказал, что его машина имеет погрешность в одну ошибку на каждые 20 000 единиц.
Настоящим прорывом в технологии, по словам доктора Черча, станет возможность секвенировать геном человека за 5000 долларов с точностью до одной ошибки на 100000 единиц.
Машина для секвенирования ДНК доктора Квейка, размером с холодильник, работает, разбивая двойную спираль ДНК на отдельные цепи и разбивая цепи на небольшие фрагменты, которые в среднем составляют 32 единицы ДНК в длину.
Затем фрагменты ДНК фиксируются на предметном стекле. На каждой из этих привязанных нитей новая спираль выстраивается единица за единицей таким образом, чтобы генерировать свет. Добавление каждой единицы регистрируется с помощью микроскопа в машине, который может отслеживать миллиард фрагментов ДНК за раз.Поскольку две нити двойной спирали ДНК комплементарны, последовательность новых единиц, которые прикрепляются к каждой растущей нити, выявляет идентичность единиц на связанной нити.
Компьютерная программа затем сопоставляет миллиарды 32-элементных фрагментов с завершенными геномами человека, уже имеющимися в файле, и записывает сайты, в которых есть добавления или удаления к стандартной последовательности, или единицы ДНК, отличные от наиболее распространенных в Население. Полный набор этих различий делает каждого человека уникальным.
В поисках генома человека за 1000 долларов
По мнению доктора Бентли, потребность в секвенировании всего генома еще далека, но не настолько, чтобы еще слишком рано думать о последствиях получения такой информации. Он считает, что два человека должны контролировать доступ к последовательности генома человека — пациент и врач.
Почему не только пациенту? Доктор Бентли сказал, что геномы будет настолько сложно правильно проанализировать, что их интерпретация должна оставаться в рамках медицинской профессии.В противном случае появятся услуги фрилансеров, предлагающие предсказать, заболеет ли человек сердечным заболеванием или возраст его смерти. Эта возможность дезинформации «окажет огромное негативное влияние на использование генетической информации в медицине», — сказал доктор Бентли.
Недавний пример генетической дезинформации произошел в прошлом месяце, когда генеалогическая компания Oxford Ancestors, занимающаяся тестированием ДНК, сообщила Томасу Робинсону, бухгалтеру из Университета Майами, что он является потомком Чингисхана. Только потому, что г.Робинсон попытался получить второе мнение, обнаружил ли он, что информация неверна.
Технологии, а не медицина — непосредственная движущая сила поисков генома человека стоимостью 1000 долларов. Новые декодирующие машины разрабатываются потому, что они возможны, а не потому, что они требуются в больницах. Но производители ожидают, что спрос будет расти по мере того, как исследователи будут находить новые применения.
«По мере того, как мы снижаем цену и увеличиваем возможности, появляются приложения, которые невозможно было сделать раньше», как исследователь, который может проверить тысячу пациентов на мутации рака, доктор.- сказал Гилберт.
В настоящее время в клинической практике врачи контролируют лишь несколько генов, и специальные тесты на эти гены делают ненужным декодирование всего генома человека. Но в какой-то момент новые машины или их преемники могут превратить расшифровку генома в обычный медицинский тест.
Каждый новорожденный ребенок уже переносит укол в пятку, чтобы набрать несколько капель крови, которые проверяются на наличие небольшого количества ферментов. Но когда геномы можно расшифровать за 1000 долларов, ребенок может прийти домой, как новый компьютер, с его полными генетическими инструкциями по эксплуатации на DVD.
Стоимость генома человека — Блог о секвенировании генома для повседневных людей
Что вы хотите от своей ДНК?
Если вы хотите расшифровать свой собственный геном, вам доступно множество вариантов, и если вы начнете проводить исследования (как мы надеемся, вы это сделаете!), Вы скоро обнаружите очень широкий спектр вариантов стоимости генетического тестирования. . На самом деле, такой широкий, он будет как минимум в 10 раз! Так что же дает? Какова соответствующая цена за расшифровку вашего генома?
Ну, это зависит от того, что вы ищете…
Вы просто ищете последовательность ДНК?
Или вы ищете последовательность ДНК плюс ее значение или ее интерпретацию? Для простоты мы сосредоточимся только на медицинских интерпретациях, так как все остальное, что вы можете попытаться расшифровать из своей ДНК, скорее всего, не будет иметь научно доказанной обоснованности, то есть, если вы не интерпретируете свою ДНК для подлинной По клиническим причинам, вы просто играете и развлекаетесь, и это здорово, но помните о безопасности ваших данных ДНК.Или действительно, безопасность данных ДНК всех ваших нынешних и будущих родственников.
И чтобы прояснить медицинскую интерпретацию ДНК, речь идет не о том, как вы обращаетесь с витаминами и добавками или как вы реагируете на пищу (иногда это неточно называют нутригеномикой). По большей части, ничто из этого не подтверждено клинически, поскольку основано на научных наблюдениях, точность которых еще не подтверждена. В настоящее время мы можем использовать нашу ДНК для медицинских целей, так это для диагностики определенных состояний или, более часто, для определения генетической предрасположенности к состоянию (включая предрасположенность к раку, который обнаруживается чаще всего).Данные также могут использоваться для определения того, как можно использовать определенные лекарства на основе вашего профиля ДНК (фармакогенетика), и, наконец, что, если вы можете быть носителем определенных мутаций ДНК, которые могут повлиять на ваших детей, не влияя (обычно) на вас.
Итак, с чего начать?
Самый дешевый геном на планете
Позвольте представить Veritas Genetics, компанию из Массачусетса, которая сразу же стала известна как первая в мире компания, предлагающая персональные геномные тесты для секвенирования и интерпретации менее чем за 1000 долларов, а затем стала компанией, которая стала еще более известной благодаря расширению финансовых границ. того, что нужно заплатить, чтобы их геном был расшифрован.
В то время, когда Veritas объявила, что предложит пакет генома за 1000 долларов (март 2016 г.), это было удивительным технологическим достижением, учитывая, что стоимость производства первой последовательности генома человека всего пару десятилетий назад составляла всего лишь 3 миллиарда долларов. На самом деле, этот ценник до сих пор поражает! Merogenomics имеет дело, пожалуй, с одним из лучших поставщиков медицинских интерпретаций генома человека, и это имеет более высокую цену, чем эта! Один только компонент затрат на секвенирование ДНК займет значительную часть этой стоимости теста ДНК в 1000 долларов (мы не будем спекулировать, что это такое [кашель, кашель, посмотрите ссылку выше], но даже если предположить, что инструменты, которые выполняли секвенирование, уже окупились — и они недешевы — и компания делала это по себестоимости, вы все равно будете смотреть на несколько сотен долларов).И дело всегда в интерпретации.
И Veritas стал королем, когда дело дошло до предложения самого дешевого полного секвенирования генома и всего, что даже отдаленно близко к клинической интерпретации. Ранее в этом году они объявили, что снизили цену до 600 долларов за геном, чтобы конкурировать с такими гигантами тестирования ДНК, как 23andMe и Ancestry. И если вы уже думали, что это довольно хорошая цена, год назад, на очень короткий момент, Veritas снизила свои цены до 200 долларов, что на данный момент, вероятно, является рекордом по самой низкой цене.Это было ограниченное предложение, которое продлилось всего несколько часов из-за спроса! И компания рассчитывает, что они смогут снова предложить эту цену в недалеком будущем.
Кроме…
В декабре 2019 года Veritas объявила о прекращении операций в США! Очевидно, не хватало средств от инвесторов, которые, по-видимому, остыли, потому что некоторые китайские компании также инвестировали в Veritas, что является своего рода запретом в нашей нынешней политической среде недоверия между США и Китаем.
Грязная тайна: ручное лечение
С такой ценой надо было что-то отдать! Долгое время считалось, что такая цена стала возможной благодаря полностью автоматизированному процессу с минимальным ручным лечением, а это означало, что время, затрачиваемое людьми на результаты, было критическим фактором надежности. Ручное лечение гарантирует, что результаты должным образом соответствуют клиническим симптомам пациента, а также убедитесь, что вы нашли то, что в настоящее время известно о мутациях ДНК, обнаруженных у пациентов, и т. Д., чтобы поставить диагноз как можно точнее. А иногда для этого требуется целая команда медицинских и научных профессионалов! Поскольку Merogenomics не желает идти на компромисс в отношении наилучшего качества интерпретации, а для этого требуются огромные ресурсы, мы считаем, что предлагаемые нами цены являются очень хорошим эталоном качества того, что следует учитывать при проведении высококачественного теста ДНК. Можно ли получить такое же качество по более низкой цене? Наверное, где-то есть, но не намного ниже. Если вы заметите, что затраты на 25% ниже наших цен, начните расследование.
Таким образом, 1000 или даже 600 долларов за получение того, что может считаться одной из самых ценных с медицинской точки зрения информации о себе и своей ДНК, включая ее медицинскую интерпретацию, были просто поразительной ценой. Кроме того, результаты якобы были доступны покупателю в приложении на телефоне (это еще одна целая банка червей)! Сообщается, что Veritas действительно контролировала результаты со стороны людей до того, как были опубликованы окончательные отчеты, но остается вопрос: чего достаточно, а чего слишком мало? Когда дело доходит до медицинской информации, искусственный интеллект может только на очень многое (хотя мы согласны с тем, что очень важный процесс фильтрации такого большого количества информации, который может быть обнаружен в вашем геноме, — это то, где ИИ является обязательным).В конечном итоге также необходим медицинский надзор со стороны человека, основанный на качественном опыте работы с реальными данными о пациентах. Именно эти интуитивные связи, которые может обеспечить только человеческий разум, не могут быть заменены машиной. Распознавание удивительной закономерности посредством связывания неясных воспоминаний из прошлых наблюдений, которые могут разгадывать необычные загадки — вот где человеческий интеллект и опыт не имеют себе равных.
«Дать» могло также быть количество медицинских состояний, рассматриваемых для интерпретации и отчетности на основе полного генома.Другими словами, это звучит так, как будто ваш полный геном мог быть полностью расшифрован, но они проанализировали бы его только частично. По одной из версий, Veritas могла изучить только 200 генетических предрасположенностей. Что ж, вас удивит, что вы потенциально можете интерпретировать геном для гораздо большего количества условий? Число на самом деле постоянно растет, но вместе с тем понимание того, как следует интерпретировать мутации ДНК, и делать это для тысяч состояний во всем геноме, является довольно сложной задачей.Кроме того, другим фактором мог быть уровень исследования, без возможности предоставить тщательный анализ даже в тщательно изученных областях, таких как определенные типы структурных вариантов ДНК (изменения ДНК, охватывающие большие участки). Veritas ранее сообщала о сокращении масштабов своего теста ДНК по сравнению с другими предложениями на рынке.
Война на ДНК-тест стоимость
Хотя мы задавались вопросом об особенностях их предложения, ценовая война за полное секвенирование генома также является захватывающей новостью, поскольку она подтверждает, что тенденция к принятию общественностью секвенирования генома ускоряется и, как ожидается, принесет финансовые выгоды в будущем.Есть и другие компании, предлагающие аналогичный ценовой диапазон Veritas. Финансовые вложения Veritas, должно быть, были чудовищными, учитывая, что только с 2014 года Illumina, крупнейший в мире производитель машин для секвенирования ДНК, объявил о способности производить геном за 1000 долларов, не считая его интерпретации! И чтобы получить такую цену с использованием новейших технологий Illumina того времени, потребовалось вложить десятки миллионов долларов в инструменты и работу машин.
Что ж, Veritas упомянула на своем сайте, что они инвестировали миллионы. По данным Allseq, калифорнийской торговой площадки для онлайн-секвенирования для исследователей, в то время для того, чтобы достичь стоимости тестирования ДНК генома человека в 1000 долларов, требовались первоначальные инвестиции в размере 10 миллионов долларов только на оборудование и для бесперебойной работы этих машин 24. часов в день в течение 4 лет подряд (что означает анализ минимум 72 000 геномов человека при эксплуатационных расходах в 62 миллиона долларов, не считая других эксплуатационных расходов).И это было просто для того, чтобы снизить стоимость секвенирования ДНК до этого уровня! Несмотря на то, что усовершенствования в химии секвенирования и увеличении производительности оборудования еще больше снизили затраты, мы все еще говорим об огромных финансовых вложениях. Машины для секвенирования генома человека действительно созданы для секвенирования в больших популяциях.
Неудивительно, что некоторые люди ломают голову над тем, как Veritas может предоставлять такие услуги в настоящий момент и получать прибыль! Это могло быть еще одной причиной дешевого предложения — компания просто выкачивала деньги из этих первоначальных инвестиций, чтобы захватить долю рынка, надеясь на выплату позже в других доходах, либо путем повторной интерпретации данных ДНК для клиента ( потенциально пожизненная услуга), или путем партнерства с другими заинтересованными сторонами в получении доступа к объединенным данным ДНК клиентов (например, партнерство 23andMe с фармацевтическим гигантом GlaxoSmithKline).Но пока кажется, что Veritas не продержалась до этого момента.
Но это ясно показывает, что интерес к публичному доступу к секвенированию генома уже начался, и конкуренция накаляется! Геном за 1000 долларов долгое время считался важной вехой, необходимой для того, чтобы секвенирование генома стало мейнстримом. В то время как тысячи людей, по оценкам, секвенировали свой геном в процессе научных открытий, считается, что именно массовое популяционное секвенирование требуется для выявления сложных вариаций, которые приводят к сложным фенотипам, включая такие заболевания, как сердечно-сосудистые заболевания или диабет. .
Врачи и тестирование ДНК: незаменимая смесь
Однако, чтобы клиент мог секвенировать свой геном с помощью Veritas, врач клиента все равно должен будет запросить это от его имени. Для некоторых это может быть препятствием, и не всем поставщикам услуг требуется такой путь, но Veritas, возможно, выбрала этот путь, чтобы снизить шансы на то, что FDA решит применить строгие правила, и получить дополнительную выгоду от врачей, имеющих немедленный доступ к клиентам. ‘результаты, обеспечивая правильную медицинскую интерпретацию и действия в случае необходимости.Требование к врачу для получения результатов теперь является общим стандартом, и если врач не требуется, следует внимательно еще раз взглянуть на то, что на самом деле предоставляет эта конкретная компания по тестированию ДНК. Вот минимальный критерий , который должен соответствовать тесту ДНК, чтобы удовлетворить врача и, следовательно, конечного пользователя.
Одна потенциальная проблема, связанная с надзором врача, — это необходимость защиты конфиденциальности данных ДНК. Это должно включать в себя врача, за исключением результатов, когда известно, что медицинское вмешательство необходимо.Предоставление врачу только соответствующей информации о ДНК поможет ограничить еще одну часто цитируемую критику геномных услуг, ориентированных непосредственно на потребителя, поскольку она перегрузит систему здравоохранения информацией о ДНК, которая, как ожидается, не будет иметь клиническую ценность или полезность. В правильно спроектированной системе наблюдающий практикующий врач может сосредоточиться только на наиболее важных (таким образом подтвержденных) результатах — тех, которые отмечены либо как патогенные, либо как вероятно патогенные. Именно так структурированы отчеты, предлагаемые поставщиками ДНК-тестов, с которыми сотрудничает Merogenomics.Врачи могут получить доступ к дополнительной генетической информации по мере необходимости, но это редко потребуется, помимо того, что им сообщается в отчете.
Veritas, с другой стороны, упростила обмен результатами и даже использовала идею передачи их вашему тренеру по фитнесу! В последний раз, когда мы проверяли, фитнес-тренеры практически не имели профессиональной подготовки по интерпретации анализа ДНК. Что впечатляло, так это легкий доступ, который Veritas предоставляла любому клиенту с генетическим консультантом, очень важная услуга, которую каждый клиент должен обязательно учитывать до и после теста.
Хотя мы явно предвзято относимся к поддержке публичного доступа к секвенированию генома, учитывая, что мы стремимся создать лучшую консалтинговую компанию для обучения клиентов их выбору услуг секвенирования, пока наша медицинская система не установит использование секвенирования генома в профилактических целях (и тенденции уже указывают на это), человек должен иметь право информировать себя о потенциальных преимуществах открытия информации, закодированной в его ДНК.
Просто помните, что дешевле — не всегда лучше, и когда дело доходит до полного секвенирования генома, в игру вступают многие аспекты. Если вы хотите получить наилучшую текущую клиническую интерпретацию, тогда более дешевые тесты ДНК могут диктовать простую точку зрения, которую необходимо профессионально пересмотреть: какую информацию вы готовы упустить по ходу дела? Практическое правило: вы получаете то, за что платите.
Не ждите слишком долго, это может быть долгое ожидание
Собираемся ли мы снизить стоимость тестирования ДНК?
Определенно, тесты на секвенирование генома будут и дальше дешеветь! Технологические прорывы будут способствовать этому.Однако в какой-то момент нам придется достичь предела, определяемого стоимостью человеческого участия. До тех пор, пока наша интерпретация генома не станет настолько глубокой, что такой компонент можно полностью удалить, всегда будут дополнительные расходы на медицинского генетика, наблюдающего за результатами теста, если вам нужен лучший тест ДНК.
Кроме того, вы не можете знать, когда может произойти это снижение цен, поскольку это зависит от усилий всей отрасли — это может произойти вскоре или может занять много времени, в зависимости от того, на чем сосредоточено внимание.В последнее время целью отрасли было не снижение цен, а скорость получения данных, и это совершенно другой фокус, поэтому стоимость секвенирования ДНК стабилизировалась в течение нескольких лет.
Адаптировано из https://www.genome.gov/about-genomics/fact-sheets/DNA-Sequencing-Costs-Data
Тогда следующий вопрос: готовы ли вы подождать? Если вы кажетесь здоровым, ответ может быть простым (хотя помните, как часто предполагаемые здоровые люди обнаруживают генетические проблемы), и мы уже знаем, какова приемлемая стоимость их секвенирования генома.Но если у вас есть семейная история болезни или неожиданного состояния, и вы не смогли получить какое-либо клиническое подтверждение, тестирование ДНК может быть очень важным вариантом. И последний вопрос: насколько ценна эта информация для вас сейчас? Насколько ценной была бы эта информация для любого из нас, если бы мы знали, что она может спасти нашу жизнь?
Несомненно, расшифровка вашей собственной ДНК для получения медицинской информации — всегда авантюра. Но вы можете также увеличить шансы в свою пользу, выбрав высококачественный тест ДНК, такой как тот, который Merogenomics стремится предоставить вам.
Эта статья подготовлена Merogenomics Inc. и отредактирована Джейсоном Чуинаром, бакалавром наук. Воспроизведение и повторное использование любой части этого контента требует разрешения Merogenomics Inc. и ссылки на источник. Вы несете ответственность за получение дополнительных разрешений от сторонних владельцев, на которые может ссылаться Merogenomics Inc. Merogenomics Inc. не несет никакой ответственности за любое использование вами содержимого, принадлежащего третьим лицам без их разрешения.
Продукты и услуги, продвигаемые Merogenomics Inc.
Выбрать целевую группу для тестирования ДНК
| Проверка здоровья | Недиагностированные болезни | Рак | Пренатальный |
Или выберите популярный тест ДНК
| Панель фармако-генетических генов | Неинвазивный пренатальный скрининг | Панель генов предрасположенности к раку | Полный геном |
Разблокировка моего генома: оно того стоило?
Однажды октябрьским утром я лихорадочно копался по квартире, пытаясь найти флешку.
Это, наверное, самый ценный флэш-накопитель, который у меня когда-либо был, и я не мог поверить, что потерял его. Он содержит план того, кем я являюсь: мой геном. Или, по крайней мере, во всем, чем мои гены отличаются от чужих.
Оказывается, по большому счету, мы все очень, очень похожи генетически: 99,9 процента генов людей идентичны. Именно в этой последней одной десятой процента мы находим все человеческие различия — те вещи, которые делают нас особенными: спортивные способности (не так много в моем случае), вьющиеся волосы (к сожалению для меня) … и в некоторых случаях предрасположенность к болезням.
В августе я отправился на секвенирование своего генома, в основном из любопытства. Не было проблемы, которую я пытался решить, или конкретного ответа, который я искал. Это ставит меня в меньшинство людей, чей геном сегодня секвенирован. Как любит говорить мне мой генетик, доктор Роберт Грин из Гарвардской медицинской школы, я принадлежу к группе пионеров медицины.
Это, конечно, заставило меня почувствовать себя очень круто, но секвенировать ваш геном — это страшная вещь. Что, если я узнаю что-то ужасное? Что, если мне суждено было заразиться неизлечимой болезнью? Что, если бы у меня были мутации, которые могли бы обременять моих будущих детей чем-то ужасным? Я действительно хотел знать?
Очевидно, учитывая мою охоту за флэш-накопителем, ответ — да.Наша способность наносить на карту наши собственные гены будет составлять все большую и большую часть нашей медицинской помощи даже в ближайшее десятилетие. Президент Барак Обама объявил об Инициативе точной медицины, чтобы ускорить то, что возможно с использованием этой генетической информации. И уже секвенирование генов оказывает серьезное влияние на лечение рака, диагностику и разработку лекарств.
Но все еще остается спорным вопрос о том, сколько секвенирования генома необходимо или даже очень полезно на личном уровне. Возникают огромные вопросы о стоимости, конфиденциальности и наших собственных способностях справиться с подобными знаниями о самих себе.
Я собирался узнать это о себе.
Мэг Тиррелл из CNBC показывает последовательность своего генома в приложении для iPad от Illumina.
Адам Джеффри | CNBC
Секвенирование
Поскольку секвенирование здоровых людей не является обычной медицинской практикой, сделать это не так-то просто. Я участвовал в программе под названием «Узнай свой геном», предоставленной компанией Illumina по секвенированию. За 2900 долларов Illumina делает то, что известно как последовательность всего генома, картируя все A, T, C и G, которые составляют мои 3 миллиарда пар оснований ДНК.(CNBC оплатила секвенирование.)
Illumina также связала меня с Грин, моим генетиком (посещения которого покрывались моей страховкой).
«Для вас важно представить, что бы вы почувствовали, если бы узнали, что у вас есть мутация», что говорит о том, что я направляюсь к какой-то неизлечимой, катастрофической болезни, — сказал Грин, который связан с Бригамом и женской больницей в Бостоне меня в первый раз, когда мы встретились.
«Ты с этим согласен?» он спросил.»Готовы ли вы узнать это, если он упадет вот так?»
По правде говоря, я не был уверен, что буду чувствовать. Я надеялся, что мой ответ будет продуктивным, ударом в штаны, чтобы максимизировать время, которое у меня было, или, в более позднем возрасте, я лучше подготовлюсь к чему-то вроде болезни Альцгеймера.
Но на самом деле, более вероятно, что я полагался на тот факт, что крайне маловероятно, что я буду предрасположен к чему-то вроде ранней болезни Альцгеймера, учитывая, насколько редко она встречается в целом и что она никогда не появлялась. моя семья.
Но, как я обнаружил, было также маловероятно, что я узнаю что-то особенно полезное или «действенное», как это описывают генетики, например, доминантную мутацию, которая предрасполагает меня к излечимому раку или болезни сердца. (У нас есть две копии каждого гена; одна от нашей мамы и одна от нашего отца. Доминантная мутация — это такая мутация, при которой требуется только одна копия для проявления ее эффектов; рецессивная требует двух копий.)
Согласно Зеленый, только от 1 до 2 процентов людей получают «действенный» результат.Я узнал, что отчасти это связано с тем, что мы все еще находимся на раннем этапе интерпретации нашей собственной генетической информации, а отчасти потому, что наши гены не определяют все в нашей жизни.
Есть много споров о том, стоит ли это секвенировать … потому что не было доказано, что вы можете что-то изменить и изменить их результат.
Д-р Роберт Грин
Генетик Гарвардской медицинской школы
«Есть много споров о том, стоит ли секвенировать большое количество людей, чтобы найти этих немногих», — сказал Грин.
Мне казалось, что те немногие наверняка сочтут, что оно того стоит. Но, по его словам, «есть даже споры о том, если вы найдете этих немногих, действительно ли вы собираетесь им помочь, потому что не было доказано, что вы можете что-то изменить и изменить их результат».
Как технологии открывают доступ к огромному количеству данных о здоровье
Варианты неизвестного значения
Если кажется, что секвенирование генома вызывает больше вопросов, чем дает ответов, то это происходит из-за огромного разрыва между тем, что технология секвенирования позволяет нам открыть, и тем, сколько мы на самом деле понимать информацию, которую мы получаем.
Поскольку секвенирование генома еще совсем недавно, у нас есть только полтора десятилетия исторических данных, из которых можно сделать выводы. Наше понимание всех последствий нашей генетики еще не догнало мощь технологий секвенирования.
Таким образом, хотя до 2 процентов людей могут получить открытие, с которым они могут что-то сделать, у 20 процентов есть какая-то доминантная мутация без каких-либо признаков болезни, сказал Грин. Это означает, что исследователи подозревают, что мутация связана с болезнью, но на самом деле она еще не проявилась, и неясно, произойдет ли и как.
Мой отчет вернется с разделом, озаглавленным «Варианты неизвестной значимости» — мутации, для которых имеется ограниченное свидетельство значимости для болезни, но которые нельзя с уверенностью считать. Оказалось, что у меня есть два, помеченных как «подозрительные» с точки зрения того, могут ли они вызвать заболевание. Не самое обнадеживающее слово, которое можно найти в отчете о секвенировании генома. Но это зависит от того, сколько мы знаем о генах и болезнях.
«У нас есть большая куча генов, которые, как мы можем сказать, связаны с шизофренией, ранним сердечным приступом или многими другими вещами», — сказал д-р.Эрик Ландер, директор Института Броуда Гарварда и Массачусетского технологического института. «Но до сих пор идет рукопашный бой с генами, чтобы выяснить, что они на самом деле делают».
The Broad — это некоммерческий исследовательский институт, который, помимо прочего, является одним из крупнейших в мире центров секвенирования генома. Лендер также был одним из руководителей проекта «Геном человека», 15-летней одиссеи по нанесению на карту первого генома человека.
«Самая чудесная карта»
«Без сомнения, это самая важная и самая чудесная карта, когда-либо созданная человечеством», — сказал президент Билл Клинтон в своем заявлении в Белом доме по завершении проекта.«В ближайшие годы врачи будут все в большей степени способны лечить такие болезни, как болезнь Альцгеймера, Паркинсона, диабет и рак, воздействуя на их генетические корни».
Это было 26 июня 2000 года. Пятнадцать лет спустя мы не видели этих лекарств — по крайней мере, не во всех случаях. Но исследователи указывают на успехи, достигнутые, в частности, в области рака, где расшифровка генетической сигнатуры опухоли может указать на более целенаправленное лечение, чем химиотерапия, которая по сути покрывает тело ядом.И исследователи недовольны идеей, что такого рода медицинские достижения должны были быть немедленными.
«Вы можете указать на все виды удивительных вещей, которые происходят, но мы находимся в этом в долгосрочной перспективе», — сказал Ландер. «И в конечном итоге это последовательность генома, генетическая вариация, все гены, ответственные за это, механизм, с помощью которого они работают, способы, которыми вы могли бы вмешаться… а затем методы лечения».
«Я считаю, что это многодесятилетнее усилие», — продолжил Ландер.«Это работа 21 века».
Однако за эти полтора десятилетия многое изменилось. В частности, резко снизилась стоимость секвенирования генома.
Превосходя закон Мура
У генетиков есть графики, которые они любят показывать на конференциях. В нем показана стоимость секвенирования одного человеческого генома в соответствии с законом Мура — прогнозом соучредителя Intel Гордона Мура, согласно которому вычислительная мощность будет экспоненциально увеличиваться при одновременном снижении стоимости.
Это показывает, что стоимость секвенирования генома резко расходится примерно в 2008 году, упав с почти 10 миллионов долларов до почти 1000 долларов сегодня.
На создание первого генома человека потребовалось 2,7 миллиарда долларов и почти 15 лет. Сейчас, по словам аналитика Cowen Дуга Шенкеля, секвенирование и анализ генома обходятся примерно в 1400 долларов. По его словам, секвенирование может быть выполнено за несколько дней, а анализ — за несколько недель.
Большая часть этого прогресса была достигнута благодаря компаниям, в том числе Illumina, поставщику технологий секвенирования из Сан-Диего, рыночная стоимость которого почти утроилась за последние пять лет и составила более 25 миллиардов долларов.В этом году компания планирует рекорд продаж, превышающий 2 миллиарда долларов, и прогнозирует, что ее общие рыночные возможности превысят 20 миллиардов долларов.
Один из основных конкурентов Illumina, Life Technologies, был приобретен компанией Thermo Fisher Scientific в феврале 2014 года за более чем 13 миллиардов долларов. Швейцарская фармацевтическая компания Roche также участвует в секвенировании вместе с несколькими более мелкими игроками.
Джей Флэтли, исполнительный директор Illumina, говорит, что стоимость секвенирования генома будет продолжать снижаться в течение следующих пяти лет.
«Мы не объявляли, что, по нашему мнению, они могут получить, но очевидно, что получение генома за 500 долларов технологически возможно», — сказал мне Флэтли на конференции по генетике в Балтиморе. «И мы думаем, что потенциал есть далеко за пределами этого».
Тек изображение | Библиотека научных фотографий | Getty Images
Precision Medicine Initiative
Но все же остается вопрос: что нам делать со всей этой информацией? Во всем мире предпринимаются огромные усилия по расширению наших знаний о генетике, и многие надеются, что Инициатива Обамы по прецизионной медицине, объявленная в его Государстве Союза ранее в этом году, будет выполнять ту же роль, что и Проект генома человека, продвигая наше понимание генетики шаг дальше.
В рамках инициативы президент предложил создать базу данных о здоровье миллиона американцев. Некоторые видят в будущем возможность секвенирования генома, чтобы соединить эти данные о здоровье с генетической информацией: объединить генетические предположения о том, что может случиться в чьей-то жизни, с тем, что происходит на самом деле.
И чтобы действительно добиться прогресса, нам нужно больше людей, которых нужно упорядочить.
«Чтобы узнать что-нибудь, нужно сравнить геномы, — объяснил Ландер, — может быть, между десятками, сотнями или тысячами людей с болезнью или без нее.»
Эти усилия предпринимаются на всех уровнях медицины и исследований — от индивидуальных систем здравоохранения до промышленности и таких стран, как Англия, сосредоточенных на сборе генетической информации своих граждан.
Я согласился предоставить свою генетическую и медицинскую информацию биобанк в больничной системе Грина, Partners HealthCare, в Бостоне. Это позволяет им просматривать как мои гены, так и мои медицинские записи в исследовательских целях.
Однако сначала я получил свой собственный взгляд на свой геном.
Что я узнал
Я не буду притворяться, что не нервничал, когда пришли мои результаты. Это был мой последний шанс отказаться. После 2900 долларов и недель ожидания я все еще мог выбрать невежество.
«Есть что-нибудь действительно плохое?» Я спросил Грина и моего генетического консультанта Шейлу Сутти по телефону в пятницу днем в сентябре.
Нет, мне сказали. У меня не было ничего из того, что действительно изменило бы мои взгляды на мою жизнь. Но это не значило, что мне не о чем было думать.
У меня был только один результат в разделе «Клинически значимые результаты» в отчете, предоставленном Illumina: у меня есть одна копия мутации под названием Factor V Leiden.
«Это означает, что ваша кровь на самом деле свертывается немного быстрее, чем у людей, у которых нет этой мутации», — сказал мне Грин тоном голоса, которым кто-то пытается избежать паники у сидящего. напротив них.
Насколько быстрее? — подумал я, мгновенно мысленно наказывая себя за все эти долгие перелеты на самолете, когда я никогда не вставал и не растягивался.У меня мог образоваться тромб и я умерла!
Это, по словам Грина, был поучительный момент.
«Лейденская мутация фактора V — отличный пример того, как связь генома может казаться хуже, чем она есть на самом деле», — сказал он. Это из-за разницы между относительным и абсолютным риском.
Эта мутация увеличивает вероятность образования тромба у меня в шесть раз по сравнению с тем, у кого его нет, что звучит довольно пугающе. Но, как это бывает, средний взрослый человек без этой мутации имеет только 1 из 1000 риск получить тромб.Так что мой риск по-прежнему составляет всего 6 из 1000, или 0,6 процента.
Так что мне с этим делать? Как оказалось, рекомендации очень похожи на то, что мы все должны делать в любом случае: поддерживать здоровый вес, заниматься ежедневными упражнениями, не курить и делать перерывы для прогулок во время длительных поездок на машине или самолете.
«Этого много в геномной информации», — сказал Грин. «То, что мы знаем, мы должны делать в любом случае, но иногда мы получаем подкрепление».
Забегая вперед
Но мой отчет на этом не закончился.Я также получил информацию о моем статусе оператора связи, о вещах, которые не повлияют на меня, но потенциально могут появиться, если у меня будут дети. Это рецессивные мутации, из которых у меня есть только одна копия.
И появятся ли они в следующем поколении Тирреллов, конечно, также будет зависеть от генетики моего партнера: если бы он также нес любую из этих мутаций, наши дети имели бы 25-процентный шанс получить две копии и иметь болезнь.
Оказалось, что у меня есть три из этих рецессивных вариантов болезней, о которых я никогда не слышал, но которые будут поистине разрушительными.Это дает мне возможность провести тестирование моего партнера, чтобы те могли оценить наш риск передачи этих болезней нашим детям, потенциально открывая совершенно новый круг вопросов «хотим ли мы знать?» Когда-нибудь в будущем.
По словам Шенкеля из Cowen, все больше и больше подающих надежды родителей задают себе такие вопросы, как использование генетического тестирования во время бума репродуктивного здоровья. Он сказал, что ежегодно в Соединенных Штатах проводится около 2 миллионов тестов на носительство, и указывает на потенциальный рынок репродуктивного здоровья на сумму более 3 миллиардов долларов.
Персонализация моего лекарства
В дополнение к моим генетическим признакам потенциального заболевания, мои результаты включали отчет о фармакогеномике, в котором анализировалось, как мои гены показывают, что я могу реагировать на 12 различных лекарств, от разжижителей крови, таких как варфарин и плавикс, до лекарства, снижающего уровень холестерина Зокор. .
Многие полагают, что это будет одним из ближайших приложений секвенирования генома в медицине с использованием наших генетических сигнатур, чтобы улучшить то, как мы подбираем правильные лекарства для правильных пациентов.
Мой геном подсказывает мне, что я не должен принимать, например, препарат под названием элтромбопаг, который продается компанией Novartis под торговой маркой Promacta и увеличивает выработку тромбоцитов. Тромбоциты способствуют свертыванию. С моей лейденской мутацией фактора V мне может не понадобиться дополнительная помощь.
Куда мы идем дальше?
Остается много вопросов о том, насколько полезно секвенирование генома для здоровых людей. Ландер, который сам был пионером в мире секвенирования, не секвенировал свой собственный геном.
«Я не думаю, что сейчас полезность в основном предназначена для частных лиц», — сказал мне Ландер. «Утилита действительно расширяет границы науки».
Есть исключения, объяснил он — если бы у него был рак, он бы секвенировал свою опухоль, «потому что есть вещи, которые можно узнать и которые имеют прямое действие».
И именно так секвенирование сегодня используется в медицине в основном: в целевых областях, таких как рак, или с целью положить конец тому, что исследователи называют диагностическими одиссеями — долгим поиском источника загадочного и серьезного недуга.
Грин, мой генетик, тоже сомневается в том, следует ли проводить секвенирование здоровых людей в медицинских целях. Он отмечает, что результаты неоднозначны. Мой, в частности, не означает, что у меня обязательно будет серьезный тромб, или что я избавлен от беспокойства о других заболеваниях, которые не отражались в моих результатах.
И всегда есть риск, что я могу слишком остро отреагировать. Согласно моему отчету Illumina, один из моих «Вариантов неизвестной значимости» — это мутация синдрома Линча, которая предрасполагает меня к определенным видам рака.Грин не согласился с этим выводом, сказав мне, что он не думает, что это то, о чем я должен беспокоиться, основываясь на его собственном анализе исследования.
Но Грина беспокоит то, что я могу переживать и искать ненужные анализы или лечение, которое может принести больше вреда, чем пользы. Или что я расскажу врачу о моем факторе V в Лейдене, и он или она неправильно поймет риск и лечит меня препаратами, разжижающими кровь, которые мне не нужны.
Я узнал, что не следует слишком расслабляться по поводу того, что не показал мой тест.Это не значит, что я никогда не заболею этими болезнями; это просто означает, что этот экран их не включил.
«Если вы думаете о секвенировании всего генома как о панораме, которую вы снимаете на свой iPhone, вы видите весь горизонт; вы видите разные здания и деревья и, возможно, некоторых людей на заднем плане», — объяснил Сутти, мой консультант по генетике. «Но что, если вы пытаетесь увеличить масштаб между этими деревьями, чтобы найти что-то еще? Секвенирование всего генома не гарантирует обнаружение этой небольшой области между ними, если вы не увеличите масштаб очень близко и не приблизитесь к нему.»
Так что, если бы я действительно был обеспокоен чем-то конкретным, все равно было бы важно пройти конкретный тест, а не полагаться на секвенирование всего моего генома.
Грин также предупредил, что, хотя существуют федеральные законы, защищающие от работодателей и страховщиков здоровья На основе генетической информации такой защиты нет, например, для страхования жизни.
Тем не менее, он ожидает, что в течение восьми-десяти лет секвенирование генома здоровых людей станет обычным делом, а для этой информации станет обычным делом. быть регулярной частью каждого медицинского обращения.Ожидается, что с настоящего момента затраты будут продолжать снижаться, компенсация страховщиков, как ожидается, станет более ясной, и ожидается, что больше доказательств того, насколько полезным может быть персональное секвенирование генома, может быть.
Моя книга жизни
Что касается меня, я нашел свой флэш-накопитель, который Грин называет моей «книгой жизни». И по мере того, как мы узнаем больше о генетике, благодаря тому, что все больше и больше людей будут секвенировать свои геномы, это будет только становиться более ценным.
Когда в генетике делаются новые открытия, связывающие определенные черты или заболевания с разными генами, я могу копаться в своем собственном геноме, чтобы узнать, что говорит мне мой личный план.А с помощью изящного приложения для iPad от Illumina, MyGenome, я могу добывать свою генетическую информацию для получения даже большего количества характеристик о себе, чем было указано в моем клиническом анализе.
Например, я могу найти вариант, связанный с зеленым цветом глаз, то, что я узнал, было расположено на хромосоме 15. Я был удивлен, обнаружив, что у меня его нет. Возможно, мои глаза на самом деле не зеленые?
На хромосоме 11 я обнаружил, что являюсь носителем варианта, который, по-видимому, предотвращает набор веса из-за диет с высоким содержанием жиров.Примечание для себя: ешьте больше масла.
Итак, после всего этого, я рад, что сделал это?
Да. И я был очень рад узнать свои результаты. Не могу сказать, что в результате этого я сильно изменил свою жизнь, но я начал делать перерывы для прогулок во время длительных поездок на автомобиле.
И я знаю, что то, что я не обнаружил чего-то — например, гена, предрасполагающего меня к раннему началу болезни Альцгеймера, — не означает, что я в опасности. Для большинства из нас гены — не наша судьба.Это план того, как мы начинаем, а затем жизнь играет важную роль.
Расшифровка нашей ДНК: Крейг Вентер против проекта «Геном человека» (научное соперничество и скандалы) (9780761354895): Карен Ганнисон Баллен: Книги
Из журнала школьной библиотеки
Gr 8 Up — эти книги демонстрируют основные научные разработки и жесткую закулисную конкуренцию. Это очень увлекательные рассказы исследователей, прибегающих к дешевым выстрелам, шпионажу и двойному переходу, чтобы получить признание за важные открытия.Но они также вызывают тревогу в документах о том, как эго может превзойти высшее благо, как, например, в битве между Люком Монтанье и Робертом Галло за открытие вируса, вызывающего СПИД. Аргументы, связанные с собственностью, и мошенничество замедлили процесс его идентификации, что, несомненно, было ценой человеческих жизней. Написанные чисто и плавно, эти названия позволяют драматизму и иногда абсурдности действий игроков говорить сами за себя. Подписанные фотографии и диаграммы хорошо соответствуют тексту, а боковые панели содержат дополнительные факты.Подробные временные линии являются наиболее заметными из сильных дополнительных функций. Этот увлекательный набор будет одинаково полезен в классах истории и естествознания. (C) Copyright 2011. Library Journals LLC, дочерняя компания Media Source, Inc. Распространение запрещено.
Из списка книг
Этот небольшой том из серии «Научное соперничество и скандалы» знакомит с гонкой за секвенированием генома человека, где ученые соревнуются за возможную славу, богатство и место в истории.С одной стороны, среди игроков были Джеймс Уотсон, который первым возглавил американское отделение международного проекта «Геном человека», и Фрэнсис Коллинз, который последовал за ним на этом посту. Исследователь Крейг Вентер бросил вызов медленным и методичным темпам своего проекта, финансируемого государством, работая в частном предприятии, чтобы быстрее завершить аналогичный проект и запатентовать результаты. На небольших, довольно загруженных страницах есть несколько черно-белых фотографий, а также боковые панели и цитаты. Читатели с солидным знанием генетики вполне могут увлечься повествованием, в котором присутствует как профессиональное соперничество, так и этические соображения.Другие могут запутаться в лексике, акронимах и объяснениях технических вопросов. Тем не менее, Баллен ясно излагает обе стороны проблемы, а также возможное решение истории. 9–12 классы. — Кэролин Фелан
Об авторе
Карен Баллен имеет степень бакалавра в Колледже Каламазу в Каламазу, штат Мичиган, и докторскую степень в Университете Миннесоты.

 Геном лиственницы состоит из 12 млрд нуклеотидных оснований, что в 4 раза больше генома человека. Большой объём генома и, как следствие, большой объём входных данных, требуемый для получения качественной сборки, становится проблемой для большинства современных программ сборщиков генома (ассемблеров). Нам удалось разработать и реализовать уникальную методику поэтапной сборки генома „по частям“, которая позволяет обойти ограничения современных ассемблеров и получить надёжную сборку генома сибирской лиственницы, соответствующую исходному биологическому материалу. Наша методика позволяет осуществлять относительно быструю сборку очень больших геномов на сравнительно небольших объёмах вычислительных ресурсов»
Геном лиственницы состоит из 12 млрд нуклеотидных оснований, что в 4 раза больше генома человека. Большой объём генома и, как следствие, большой объём входных данных, требуемый для получения качественной сборки, становится проблемой для большинства современных программ сборщиков генома (ассемблеров). Нам удалось разработать и реализовать уникальную методику поэтапной сборки генома „по частям“, которая позволяет обойти ограничения современных ассемблеров и получить надёжную сборку генома сибирской лиственницы, соответствующую исходному биологическому материалу. Наша методика позволяет осуществлять относительно быструю сборку очень больших геномов на сравнительно небольших объёмах вычислительных ресурсов» Для проведения данных исследований потребовалось проведение большой подготовительной работы, начиная с обучения специалистов на мастер-классах и стажировках, закупки реактивов, заканчивая обеспечением секвенатора бесперебойной поставкой электроэнергии»
Для проведения данных исследований потребовалось проведение большой подготовительной работы, начиная с обучения специалистов на мастер-классах и стажировках, закупки реактивов, заканчивая обеспечением секвенатора бесперебойной поставкой электроэнергии» Такие базы нужны и для идентификации происхождения растительного материала в борьбе с нелегальными рубками и нелегальным оборотом древесины. Помимо прикладных задач в процессе полногеномных исследований также решаются и научные задачи фундаментального характера. Новые знания о геномах хвойных являются фундаментом для последующих исследований эволюционных, биохимических и физиологических процессов в этих организмах. Глубокие знания о структуре генома: экзон-интронной структуре генов, повторяющихся последовательностей и межгенных регуляторных участков позволят понять генетические механизмы регуляции этих процессов, а также эволюцию геномов хвойных, древнейших представителей растительного мира»
Такие базы нужны и для идентификации происхождения растительного материала в борьбе с нелегальными рубками и нелегальным оборотом древесины. Помимо прикладных задач в процессе полногеномных исследований также решаются и научные задачи фундаментального характера. Новые знания о геномах хвойных являются фундаментом для последующих исследований эволюционных, биохимических и физиологических процессов в этих организмах. Глубокие знания о структуре генома: экзон-интронной структуре генов, повторяющихся последовательностей и межгенных регуляторных участков позволят понять генетические механизмы регуляции этих процессов, а также эволюцию геномов хвойных, древнейших представителей растительного мира»